
【题目】工业上乙醚可用于制造无烟火药。实验室合成乙醚的原理如下:
主反应 2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
副反应CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
(乙醚的制备)
实验装置如图所示(夹持装置和加热装置略)

(1)仪器a是_____(写名称);仪器b应更换为下列的 ___(填字母)。
A.干燥器
B.直形冷凝管
C.玻璃管
D.安全瓶
(2)实验操作的正确排序为_____(填字母),取出乙醚后立即密闭保存。
a.组装实验仪器
b.加入12mL浓硫酸和少量乙醇的混合物
c.检查装置气密性
d.熄灭酒精灯
e.点燃酒精灯
f.通冷却水
g.控制滴加乙醇的速率与产物馏出的速率相等
h.弃去前馏分
i.拆除装置
(3)加热后发现仪器a中没有添加碎瓷片,处理方法是_____;若滴入乙醇的速率显著超过产物馏出的速率,则反应速率会降低,可能的原因是 ____。
(乙醚的提纯)
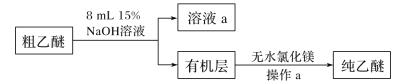
(4)用15%NaOH溶液洗涤粗乙醚的原因是____________;无水氯化镁的作用是_____。
(5)操作a的名称是____;进行该操作时,必须用水浴代替酒精灯加热,其目的与制备实验中将尾接管支管接室外相同,均为____。
【答案】三颈烧瓶 B acbfeghdi 先停止加热,待烧瓶中的溶液冷却至室温,再重新加入碎瓷片 滴入乙醇的速率过快,溶液温度骤降,导致反应速率降低 除去挥发出来的乙醇 干燥乙醚 蒸馏 避免乙醚蒸气爆炸
【解析】
装置a为三颈烧瓶,是有机制备中常见的反应器皿,一孔放温度计,一孔接分液漏斗滴加原料,另一孔导出产物,b为球形冷凝管,使产物乙醚冷凝,经牛角管(尾接管)进入圆底烧瓶中,结合资料可以发现乙醚沸点较低,因此要用冰水浴,减少乙醚挥发,据此来分析作答即可。
(1)仪器a有三个“脖子”,因此为三颈烧瓶,仪器b是球形冷凝管,应改用直形冷凝管,答案选B;
(2)实验操作顺序:按照先左后右,先下后上的顺序组装好仪器,然后检查装置的气密性,加入反应物,为防止冷凝管受热后遇冷破裂同时保证冷凝效果,先通冷却水后加热烧瓶;实验过程中控制滴加乙醇的速率与产物馏出的速率相等;实验结束时操作顺序与开始时相反,即遵循“先开后关,后开先关”的原则,答案为acbfeghdi;
(3)加热后发现仪器a中没有添加碎瓷片,不能直接补加,应先停止加热,待烧瓶中的溶液冷却至室温,再重新加入碎瓷片;若滴入乙醇的速率过快,溶液温度骤降,导致反应速率降低(其它合理答案也可);
(4)粗乙醚中混杂着挥发出的乙醇,乙醇与水互溶,因此可以用![]() 溶液来洗涤除去乙醇,而无水氯化镁是一种常见的干燥剂,可以用来干燥乙醚;
溶液来洗涤除去乙醇,而无水氯化镁是一种常见的干燥剂,可以用来干燥乙醚;
(5)操作a是蒸馏,将乙醚和氯化镁分离;乙醚在空气中遇热易爆炸,因此不能使用明火加热,只能使用水浴加热;而尾接管接室外也是为了防止室内乙醚蒸气浓度过大导致爆炸。


科目:高中化学 来源: 题型:
【题目】(1)氯酸是一种强酸,氯酸的浓度超过40%就会迅速分解,反应的化学方程式为8HClO3=3O2↑+2Cl2↑+4HClO4+2H2O。根据题意完成下列小题:
①在上述变化过程中,发生还原反应的过程是_____→____(填化学式)。
②该反应的氧化产物是________(填化学式)。
(2)已知测定锰的一种方法是:锰离子转化为高锰酸根离子,反应体系中有H+、Mn2+、H2O、IO3-、MnO4-、IO4-。有关反应的离子方程式为_____。
(3)工业尾气中含有大量的氮氧化物,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
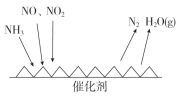
①由上图可知SCR技术中的氧化剂为_____________。
②用Fe作催化剂加热时,在氨气足量的情况下,当NO2与NO的物质的量之比为1∶1时,写出该反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2的制取及其在污水处理方面的应用是当前科学研究的热点。
(1)“氧阴极还原法”制取H2O2的原理如题图所示:
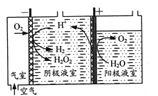
阴极表面发生的电极反应有:
Ⅰ.2H++O2+2e-=H2O2
Ⅱ. H2O2+2H++ 2e-=2H2O
Ⅲ. 2H+ +2e-=H2↑
①写出阳极表面的电极反应式:___。
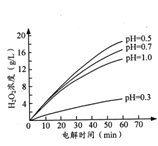
②其他条件相同时,不同初始pH(均小于2)条件下,H2O2浓度随电解时间的变化如图所示,c(H+)过大或过小均不利于H2O2制取,原因是_______。
(2)存碱性条件下,H2O2的一种催化分解机理如下:
H2O2(aq)+Mn2+(aq)=·OH(aq)+Mn3+(aq)+OH-(aq) H=akJ/mol
H2O2(aq)+ Mn3+(aq) +2OH-(aq)= Mn2+(aq) +·O2-(aq) +2H2O(l) H=bkJ/mol
·OH(aq) +·O2-(aq)=O2(g) +OH-(aq) H=ckJ/mol
2H2O2(aq)= 2H2O(l)+O2(g) △H=_______ 。该反应的催化剂为 ____。
(3)H2O2、O3在水中可形成具有超强氧化能力的羟基自由基(·OH),可有效去除废水中的次磷酸根离子(H2PO2-)。
①弱碱性条件下·OH将H2PO2-氧化成PO43-,理论上l.7g·OH可处理含0.001mol/L H2PO2-的模拟废水的体积为______。
②为比较不同投料方式下含H2PO2-模拟废水的处理效果,向两份等体积废水样品中加入等量H2O2和O3,其中一份再加入FeSO4。反应相同时间,实验结果如图所示:
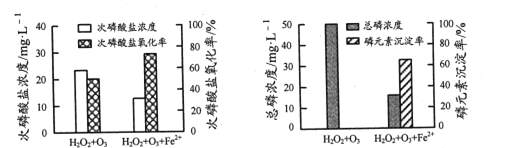
添加FeSO4后,次磷酸盐氧化率、磷元素沉淀率均显著提高,原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物6.4 g在氧气中完全燃烧,只生成8.8 g CO2和7.2 g H2O。下列说法中正确的是( )
①该化合物仅含碳、氢两种元素 ②该化合物中碳、氢原子个数比为1∶4
③无法确定该化合物是否含有氧元素 ④该化合物中一定含有氧元素
A. ①②B. ②④C. ③④D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,反应HCO3-+H2O![]() H2CO3+OH-的平衡常数为10-8 。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是
H2CO3+OH-的平衡常数为10-8 。将NH4HCO3溶液和氨水按一定比例混合,可用于浸取废渣中的ZnO。若溶液混合引起的体积变化可忽略,室温时下列指定溶液中微粒物质的量浓度关系正确的是
A.0.2mol/L 氨水:c(NH3H2O)>c(NH4+)>c(OH-)>c(H+)
B.0.6 mol/L氨水和0.2 mol/L![]() 溶液等体积混合:c(NH3H2O)+c(CO32-)+c(OH-)=0.3mol/L+2c(H2CO3)+c(H+)
溶液等体积混合:c(NH3H2O)+c(CO32-)+c(OH-)=0.3mol/L+2c(H2CO3)+c(H+)
C.0.2 mol/L氨水和0.2 mol/L![]() 液等体积混合:c(NH4+)+c(NH3H2O)=c(H2CO3)+c(HCO3-)+c(CO32-)
液等体积混合:c(NH4+)+c(NH3H2O)=c(H2CO3)+c(HCO3-)+c(CO32-)
D.0.2mol/L NH4HCO3溶液(pH>7):c(NH4+)>c(HCO3-)>c(H2CO3)>c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用绿柱石(主要成分3BeOAl2O36SiO2,还含有铁元素)冶炼铍,其简化的工艺流程如图所示:
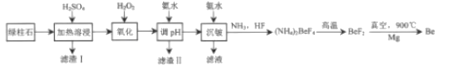
已知:Be和Al性质相似:几种金属阳离子的氢氧化物沉淀时的pH如表:
Be2+ | Al3+ | Fe3+ | Fe2+ | |
开始沉淀时 | 5.2 | 3.3 | 1.5 | 6.5 |
沉淀完全时 | 8.8 | 5.0 | 3.7 | 9.7 |
回答下列问题:
(1)滤渣Ⅰ的主要成分是______,加入H2O2的作用是______。
(2)得到滤渣Ⅱ的合理pH范围是______。
(3)用化学方程式解释不宜使用NaOH溶液来沉铍的原因是______。
(4)得到(NH4)2BeF4的化学方程式为______。
(5)由Mg还原BeF2得到Be需要真空的环境,其原因是______。
(6)若绿柱石中BeO的含量为a%,1吨绿柱石能生产含铍2%的合金b吨,则Be的利用率为______。(用含a、b的表达式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,①6.72L NH3 ②1.204×1023个 H2S ③6.4g CH4 ④0.5mol HCl ,下列关系正确的是( )
A.体积大小: ④>③>②>①B.原子数目: ③>①>④>②
C.密度大小: ④>②>③>①D.质量大小: ④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为元素周期表的一部分,下列说法不正确的是
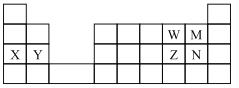
A.原子半径 X>Y
B.X、M的简单离子的电子层结构相同
C.M最高价氧化物的水化物酸性比 N 的强
D.W的简单氢化物比Z的简单氢化物稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①![]() +HNO3
+HNO3![]() +H2O ΔH<0;②硝基苯沸点210.9℃,蒸馏时选用空气冷凝管。下列制取硝基苯的操作或装置(部分夹持仪器略去),正确的是
+H2O ΔH<0;②硝基苯沸点210.9℃,蒸馏时选用空气冷凝管。下列制取硝基苯的操作或装置(部分夹持仪器略去),正确的是
A. 分液B.
分液B.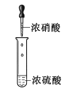 配制混酸
配制混酸
C.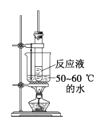 水浴加热D.
水浴加热D.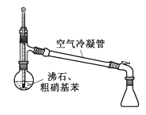 蒸馏提纯
蒸馏提纯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com