
下列离子方程式书写正确的是 ( )。
A.Na与H2O反应:Na+2H2O===Na+ +2OH-+H2↑
+2OH-+H2↑
B.Na2O与盐酸反应:O2-+2H+===H2O
C.NaHCO3溶液与稀硫酸反应:CO32-+2H+===CO2↑+H2O
D.NaOH溶液与小苏打溶液混合:HCO3-+OH-===CO32-+H2O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列叙述正确的是( )。
A.1.00 mol NaCl中含有6.02×1023个NaCl分子
B.1.00 mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023
C.欲配制1.00 L 1.00 mol·L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中
D.电解58.5 g熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0 g金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
聚乳酸是一种新型可生物降解的高分子材料,主要用于制造可降解纤维、可降解塑料和医用材料。聚乳酸材料废弃后,先水解成乳酸(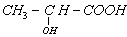 ),乳酸在微生物作用下分解为
),乳酸在微生物作用下分解为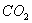 和
和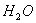 。
。
(1)乳酸的工业生产可以采用生物发酵法。

①检验淀粉是否完全水解,可以选用的一种试剂是__________(填序号)。
a. 溴水 b. 银氨溶液 c. 碘酒d. 碘化钾淀粉溶液
②用18吨葡萄糖发酵,理论上可以得到乳酸的质量是___________吨。
(2)乳酸的生产也可以采用有机合成法,其中的一种方法是丙酸法。

①反应I的反应类型是__________反应。
②进行反应II时,需要加入过量的乙醇,这样做的目的是________。
(3)两个乳酸分子之间可以形成环状的酯,该环状酯的结构简式是___________乳酸在一定条件下发生反应得到聚乳酸的化学方程式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
除去下列物质中的杂质,选用的试剂和采取的操作不正确的是
A.乙烷气体中混有乙烯:酸性高锰酸钾溶液和NaOH溶液,洗气
B.苯中混有苯酚:浓溴水,分液
C.溴化氢气体中混有溴蒸汽:四氯化碳,洗气
D.乙醇中混有乙酸:生石灰,蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下面的反应路线及所给信息填空。
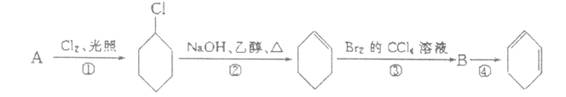
(1)A的结构简式是 ,名称是 。
(2)①的反应类型是 ,③的反应类型是 。
(3)反应③的化学方程式是 。
反应④的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2O2几乎能与所有常见的气态非金属氧化物在一定条件下反 应,如:
应,如:
2Na2O2+2CO2===2Na2CO3+O2
Na2O2+CO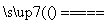 Na2CO3
Na2CO3
(1)试分别写出Na2O2与SO2、SO3反应的化学方程式:
____________________________________ _____________________________、
_____________________________、
_________________________________________________________________。
(2)通过比较可知,当非金属处于________价态时,与Na2O2反应有O2生成。
(3)等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的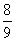 (同温同压下),这时混合气体中N2、O2、CO2物质的量之比为________。
(同温同压下),这时混合气体中N2、O2、CO2物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
SO2的水溶液和Cl2的水溶液均能使品红溶液褪色,将SO2和Cl2按1∶1体积比(同温同压)混合后通入品红溶液中,品红溶液不褪色,其原因是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组中每种物质都既有离子键又有共价键的一组是 ( )
A.NaOH、H2SO4 、(NH4) 2SO4 B.MgO、Na2SO4、HNO3
C.Na2O2、KOH、Na3PO4 D.HCl、Fe2O3、MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
周期表中前20号几种元素,其相关信息如下(铍的原子半径为0.089nm):

F原子中无中子,G在地壳中含量居第二位,H元素焰色反应呈紫色。请回答下列问题:
(1)B的原子结构示意图为__________ 。
(2) F2C和F2E两种化合物中,稳定性强的是__________(填化学式),原因是__________。
(3)写出化合物AF3的电子式__________ 。
(4)G的最高价氧化物能与H的最高价氧化物的水化物溶液反应,反应的化学方程式为_________________________________.
(5)CE2能使酸性高锰酸钾溶液褪色(有Mn2+生成),写出其反应的离子方程式_______________________________________________________.
(6)在2L密闭容器中,一定温度下,能说明反应 已达
已达
到平衡状态的是___________(填代号)

b.容器内压强保持不变
c.容器内密度保持不变
d各组分的物质的量浓度相等
e.混合气体的平均相对分子质量不再改变
(7)某同学设计了以G同族的短周期元素的最低价氢化物为燃料的电池,电解质溶液含HEF。则该电池的负极的电极反应式为_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com