
已知:稀溶液中,强酸与强碱反应中和热的数值为57.3kJ/mol。
(1)用0.1molBa(OH)2配成的稀溶液跟足量的稀硝酸反应,放出______kJ的热量
(2)1L0.1mol/LNaOH溶液分别与①醋酸溶液②浓硫酸③稀硝酸恰好反应时,放出的热量分别为Q1 、Q2 、Q3(单位:kJ),则它们由大到小的顺序是_________________________
科目:高中化学 来源: 题型:
关于淀粉、脂肪、蛋白质的说法错误的是( )
A.均是有机化合物 B.均是生活中常见的高分子化合物
C.在一定条件下均能发生水解反应 D.均能为生物体的生命活动提供能量
查看答案和解析>>
科目:高中化学 来源: 题型:
A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;它有如图所示的转化关系。E是有香味的有机物,F是高分子化合物。

(1)写出A的结构简式____________,空间构型________。
(2)B、D分子中的官能团名称分别是________、________。
(3)写出下列反应的化学方程式及反应类型:
①__________________________________;反应类型__________________。
②__________________________________;反应类型__________________。
④_________________ ______________;反应类型__________________。
⑤__________________________________;反应类型__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀
B.火电是将燃料中的化学能直接转化为电能的过程
C.将煤粉碎了再燃烧可以提高煤的燃烧效率
D.化学反应的限度不可以通过改变条件而改变
查看答案和解析>>
科目:高中化学 来源: 题型:
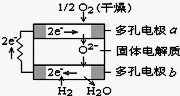
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的.它以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是
A.有O2放电的a极为电池的负极
B.a极对应的电极反应为:O2+ 2H2O+ 4e--= 4OH-
C.有H2放电的一极电极反应为:H2+O2- -2 e- =H2O
D.该电池的总反应方程式为:2H2+ O2= 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列四种X溶液,均能跟盐酸反应,其中反应最快的是 ( )
A.10℃ 20mL 3mol/L的X溶液 B.20℃ 30mL 2molL的X溶液
C.20℃ 10mL 4mol/L的X溶液 D.10℃ 10mL 2mol/L的X溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
将1 mol A2和1 mol B2通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发生反应:2A2(g)+B2(g)  2A2B(g)。反应达到平衡时A2B为0.3 mol。若此时移走0.5 mol A2和0.5 mol B2,则重新达到平衡后,A2B的物质的量
2A2B(g)。反应达到平衡时A2B为0.3 mol。若此时移走0.5 mol A2和0.5 mol B2,则重新达到平衡后,A2B的物质的量
A.小于0.15 mol B.等于0.3 mol
C.等于0.15 mol D.大于0.15 mol,小于0.3 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某矿样用过量酸溶解并过滤,所得滤液A主要含CO 、Ni2+、SO
、Ni2+、SO 、H+、Fe2+、Fe3+、OH-、Mg2+、Mn2+等九种离子中的七种。将A中金属元素进行分离以备利用,部分流程如图所示:
、H+、Fe2+、Fe3+、OH-、Mg2+、Mn2+等九种离子中的七种。将A中金属元素进行分离以备利用,部分流程如图所示:

可能用到的有关数据如下:
| 物质 | 开始沉淀的pH | 沉淀完全的pH | Ksp(25 ℃) |
| Fe(OH)3 | 2.7 | 3.7 | 4.0×10-38 |
| Fe(OH)2 | 7.6 | 9.6 | 8.0×10-16 |
| Ni(OH)2 | 7.2 | 9.2 | 5.5×10-16 |
| Mg(OH)2 | 9.6 | 11.1 | 1.2×10-11 |
请根据题给信息填空:
(1)滤液A中不能大量存在的两种离子是________。
(2)已知“滤渣1”是MnO2,步骤①发生的氧化还原反应的离子方程式为________。
(3)常温下,某Ni(OH)2、Mg(OH)2共沉淀的混合体系中,若c(Ni2+)=5.5×10-11 mol·L-1,则c(Mg2+)=________。
(4)假定步骤①中NaClO恰好反应,欲检验滤液3中的酸根离子,需优先检验________(填离子符号)。
(5)为测定该矿样中铁元素的含量,取20.0 g矿石,按上述流程操作,将________(填“滤渣1”、“滤渣2”或“滤渣3”)完全酸溶,再使其中的铁元素还原为Fe2+,然后将所得溶液稀释到100 mL,取出20.00 mL用0.100 0 mol·L-1 KMnO4溶液滴定。达到滴定终点时溶液颜色为________色,共消耗KMnO4溶液16. 00 mL,经计算矿样中铁元素的质量分数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com