
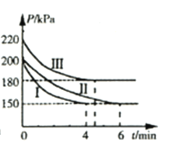
【题目】工业上用CO2和NH3合成尿素 [CO(NH2)2]。某研发小组为合成尿素进行如下实验:向5L恒容密闭容器中通入0.2molNH3和0.1molCO2,分别进行Ⅰ、Ⅱ、Ⅲ三组实验。在不同条件下发生反应:![]() ,反应体系总压强随时间的变化曲线如图所示。
,反应体系总压强随时间的变化曲线如图所示。
(1)已知:
①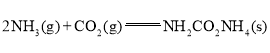
![]()
②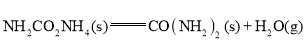
![]()
用CO2和NH3合成尿素的热化学方程式为________。
(2)Ⅰ、Ⅱ、Ⅲ三组实验中,反应温度最高的是________。(填“Ⅰ”、“Ⅱ”或“Ⅲ”)
(3)Ⅰ、Ⅲ两组实验中,NH3转化率较高的是________。(填“Ⅰ”或“Ⅲ”)
(4)若要增加实验Ⅱ的反应速率并提高NH3转化率,改变下列条件可以实现的是________(填标号)
A.增加CO2的物质的量 B.加入惰性气体使压强增大
C.升高反应的温度 D.改用2L的容器进行实验
(5)Ⅰ、Ⅱ两组实验中,反应达到平衡的时间不同,可能的原因是________。
(6)第Ⅱ组实验开始6min内NH3的平均反应速率为________![]() ,平衡常数
,平衡常数![]() ________。
________。
【答案】![]()
![]() Ⅲ Ⅰ AD 使用了不同的催化剂 0.0025 960
Ⅲ Ⅰ AD 使用了不同的催化剂 0.0025 960
【解析】
(1)根据盖斯定律进行计算;
(2)在相同的容器的反应器中,投入相同物质的量的反应物,但是反应开始的时候,Ⅲ中的压强最高,而Ⅰ和Ⅱ的压强相同,在物质的量、体积相同的情况下,压强和温度成正比;可知Ⅰ和Ⅱ的反应温度相同,反应Ⅲ的温度较Ⅰ和Ⅱ高;
(3)该反应是放热反应,升高温度,平衡逆向移动,NH3的转化率降低,据此规律进行分析;
(4)A.增加CO2的物质的量,速率加快,NH3的转化率增加;
B.加入惰性气体,但是各物质的浓度不变,不影响反应速率和转化率;
C.升高反应的温度,速率加快,平衡逆向移动;
D.改用2L的容器进行实验,相当于压缩气体,各物质的浓度增大,速率加快,平衡正向移动;
(5)反应Ⅰ和Ⅱ中NH3的转化率相同,但是反应Ⅰ的反应速率更快,说明反应Ⅰ和Ⅱ使用了不同的催化剂;
(6)在体积不变的情况下,压强和物质的量成正比。反应开始时,0.2molNH3和0.1molCO2对应的压强为200kPa,达到平衡时,压强为150KPa,可得达到平衡时,气体的总物质的量![]() ,假设CO2反应了xmol,根据反应列三等式,计算出x,从而计算出6min内NH3的平均反应速率,反应的平衡常数。
,假设CO2反应了xmol,根据反应列三等式,计算出x,从而计算出6min内NH3的平均反应速率,反应的平衡常数。
(1)根据盖斯定律,反应①+反应②可得目标反应,CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g),△H=△H1+△H2==(-159.5+116.5)kJ·mol-1=-43kJ·mol-1;
CO(NH2)2(s)+H2O(g),△H=△H1+△H2==(-159.5+116.5)kJ·mol-1=-43kJ·mol-1;
答案为CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g)△H=-43kJ·mol-1;
CO(NH2)2(s)+H2O(g)△H=-43kJ·mol-1;
(2)在相同的容器的反应器中,投入相同物质的量的反应物,但是反应开始的时候,Ⅲ中的压强最高,而Ⅰ和Ⅱ的压强相同,在物质的量、体积相同的情况下,压强和温度成正比;可知Ⅰ和Ⅱ的反应温度相同,反应Ⅲ的温度较Ⅰ和Ⅱ高;所以Ⅰ、Ⅱ、Ⅲ三组实验中,温度最高的是Ⅲ;
(3)该反应是放热反应,升高温度,平衡逆向移动,NH3的转化率降低;实验Ⅰ的温度低,可知实验Ⅰ中NH3的转化率较高;
(4)A.增加CO2的物质的量,生成物浓度增加,化学反应速率增加,NH3的转化率也增加,A符合题意;
B.加入惰性气体,但是各物质的浓度不变,反应速率和NH3的转化率均不变,B不符合题意;
C.升高反应的温度,化学反应速率增加,但是平衡逆向移动,NH3的转化率降低,C不符合题意;
D.改用2L的容器进行实验,相当于压缩气体,各物质的浓度增大,反应速率增加;压缩体积,平衡正向移动,NH3的转化率增加,D符合题意;
答案选AD;
(5)反应Ⅰ和Ⅱ中NH3的转化率相同,但是反应Ⅰ的反应速率更快,说明反应Ⅰ和Ⅱ使用了不同的催化剂;
(6)在体积不变的情况下,压强和物质的量成正比。反应开始时,0.2molNH3和0.1molCO2对应的压强为200kPa,达到平衡时,压强为150KPa,可得达到平衡时,气体的总物质的量![]() ,假设CO2反应了xmol,根据三等式,有;
,假设CO2反应了xmol,根据三等式,有;
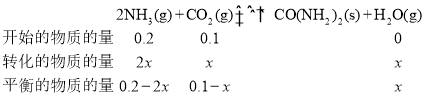
则有0.2-2x+0.1-x+x=![]() ,得x=
,得x=![]() ,6min内NH3的平均反应速率
,6min内NH3的平均反应速率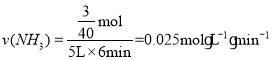 ;平衡常数
;平衡常数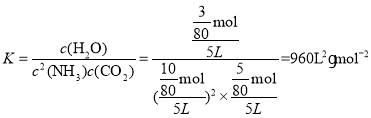 。
。


科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:H2(g) + I2(g)![]() 2HI(g) ΔH<0,现有三个相同的1 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol H2和1 mol I2(g),在Ⅱ中充入2 molHI(g) ,在Ⅲ中充入2 mol H2和2 mol I2(g),700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
2HI(g) ΔH<0,现有三个相同的1 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol H2和1 mol I2(g),在Ⅱ中充入2 molHI(g) ,在Ⅲ中充入2 mol H2和2 mol I2(g),700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
A. 容器Ⅰ、Ⅱ中正反应速率相同
B. 容器Ⅰ、Ⅲ中反应的平衡常数相同
C. 容器Ⅰ中的气体颜色比容器Ⅱ中的气体颜色深
D. 容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化率之和等于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象描述正确的是( )
选项 | 实 验 | 现 象 |
A | 向氢氧化钠溶液中滴加FeCl3饱和溶液 | 有氢氧化铁胶体产生 |
B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝滴落下来 |
C | 向滴有酚酞的溶液中加入足量Na2O2粉末 | 溶液变红 |
D | 加热放在坩埚中的小块钠 | 钠先熔化成光亮 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着新能源汽车产业的快速发展,带来大量的废旧电池,一种以废旧磷酸铁锂电池正极为原料回收铝、铁和锂元素的工艺流程如下:

已知:①![]() 易溶于硫酸中。
易溶于硫酸中。
②磷酸铁锂电池正极材料:磷酸铁锂![]() ,乙炔黑(主要成分碳单质,着火点大于750℃)导电剂和有机粘结剂PVDF(一种高分子有机物),均匀混合后涂覆于铝箔上。
,乙炔黑(主要成分碳单质,着火点大于750℃)导电剂和有机粘结剂PVDF(一种高分子有机物),均匀混合后涂覆于铝箔上。
回答下列问题:
(1)破碎的作用是________,烧结的主要目的是________。
(2)碱溶发生的非氧化还原反应的离子方程式是________________。
(3)若在实验室中进行操作1、2、3,需要用到的玻璃仪器有________。
(4)滤渣1酸浸的目的是________。
(5)滤渣2主要成分是________。
(6)pH与Fe、Li沉淀率关系如下表,为使滤液2中Fe、Li分离,溶液的pH应调节为________。
溶液pH与Fe、Li沉淀率关系
pH | 3.5 | 5 | 6.5 | 8 | 10 | 12 |
Fe沉淀率 | 66.5 | 79.2 | 88.5 | 97.2 | 97.4 | 98.1 |
Li沉淀率 | 0.9 | 1.3 | 1.9 | 2.4 | 4.5 | 8.0 |
(7)碳酸锂的溶解度随温度变化如下图所示。向滤液3中加入![]() ,将温度升至90℃是为了提高沉淀反应速率和________。
,将温度升至90℃是为了提高沉淀反应速率和________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块镁铝合金投入到1mol/L盐酸中,待合金完全溶解后(盐酸有剩余),再往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化如图所示。下列说法中错误的是( )
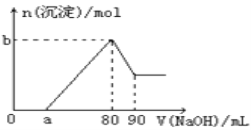
A. 盐酸的体积为80mL
B. a的取值范围为0<a<50
C. 当a值为30时,b值为0.01
D. n(Mg2+)<0.025mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学分析中,常常需要用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配制准确物质的量浓度的KMnO4溶液。用Na2C2O4固体测定KMnO4溶液浓度的实验步骤如下:(反应原理为:5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O)
步骤一:先粗配浓度约为0.15mol/L的KMnO4溶液500mL。
步骤二:准确称取Na2C2O4固体mg放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用步骤一所配KMnO4溶液进行滴定。记录相关数据。
步骤三:重复步骤二两到三次。计算得KMnO4溶液的物质的量浓度。
试回答下列问题:
(1)盛放KMnO4溶液的滴定管为___(填“酸式”或“碱式”)滴定管。
(2)该滴定实验滴定终点的现象是___。
(3)步骤二中滴定操作如图所示,正确的操作是___(填编号)。
A. B.
B. C.
C.
(4)若m的数值为1.340g,滴定的KMnO4溶液平均用量为25.00mL,则KMnO4溶液的浓度为___mol/L。
(5)若滴定完毕后读数时俯视,则实验误差会__(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子浓度关系正确的是( )
A.一定物质的量浓度的Na2S溶液中:2c(Na+)=c(S2-)+c(H2S)+c(HS-)
B.在常温下,向0.01molL-1的NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)
C.0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)
D.等物质的量浓度的NH4HSO4溶液和NH4Cl溶液,c(NH4+)前者小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应:
与铀氮化物是重要的核燃料,已知某温度下三碳酸铀酰铵可发生如下分解反应:![]() 。阿伏加德罗常数的值为
。阿伏加德罗常数的值为![]() 。
。
回答下列问题:
(1)![]() 发生裂变反应:
发生裂变反应:![]() ,净产生的中子(
,净产生的中子(![]() )数为________。基态
)数为________。基态![]() 原子的外围电子排布式为
原子的外围电子排布式为![]() ,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为________(填序号)。
,则处于下列状态的铀原子或离子失去一个电子所需的能量最高的为________(填序号)。
A ![]() B
B ![]() C
C ![]() D
D ![]()
(2)![]() 和
和![]() 中,沸点较高的为________,与
中,沸点较高的为________,与![]() 形成的配离子稳定性较高的为________。
形成的配离子稳定性较高的为________。
(3)![]() 中存在大
中存在大![]() 键,形成该大
键,形成该大![]() 键的电子数为________。
键的电子数为________。
(4)某种铀氮化物的晶体结构与![]() 相同。
相同。![]() 的Bom-Haber循环如图所示。
的Bom-Haber循环如图所示。
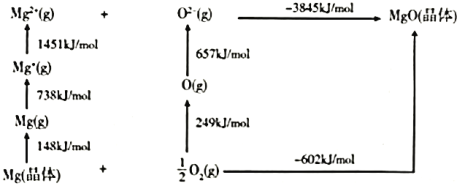
①![]() 晶格能为________
晶格能为________![]() 。
。
②![]() 的第二电离能大于
的第二电离能大于![]() 的第二电离能,是由于
的第二电离能,是由于![]() 的半径较
的半径较![]() 小、
小、![]() 的核电荷更高以及_______。
的核电荷更高以及_______。
(5)另一种铀氮化物的晶胞如下图所示,![]() “原子”作面心立方最密堆积。
“原子”作面心立方最密堆积。
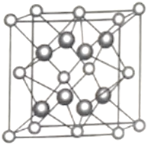
①铀元素的化合价为________,![]() “原子”的配位数为________。
“原子”的配位数为________。
②已知晶胞参数为![]() ,则晶体的密度为________
,则晶体的密度为________![]() (列出计算式)。
(列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com