

分析 由合成流程可知,合成乙二酸乙二酯,⑤为酯化反应,B为HOCH2CH2OH,D为HOOCCOOH,则①为CH2=CH2和溴发生加成反应生成A为CH2BrCH2Br,A发生水解反应生成B为HOCH2CH2OH,B发生氧化反应生成C为OHCCHO,C再氧化生成D,以此来解答.
解答 解:(1)由上述分析可知,③为氧化反应,④为氧化反应,⑤为酯化反应,故答案为:氧化反应;氧化反应;酯化反应;
(2)反应①为CH2=CH2+Br2→CH2BrCH2Br,
反应②为CH2BrCH2Br+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaBr,
反应③为HOCH2CH2OH+O2$→_{△}^{Cu}$OHCCHO+2H2O,
故答案为:CH2=CH2+Br2→CH2BrCH2Br;CH2BrCH2Br+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaBr;HOCH2CH2OH+O2$→_{△}^{Cu}$OHCCHO+2H2O.
点评 本题考查有机物的合成,为高频考点,把握逆合成法、有机反应、碳链变化为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 低压 | B. | 低温 | C. | 高压 | D. | 充足的CH4来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取样,加入稀硝酸酸化的Ba(NO3)2溶液 | |
| B. | 取样,先加稀硝酸酸化,再加Ba(NO3)2溶液 | |
| C. | 取样,先加盐酸酸化,再加BaCl2溶液 | |
| D. | 取样,加入盐酸酸化的BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
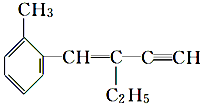
| A. | 该有机物结构简式为C13H14 | |
| B. | 该有机物属于苯的同系物 | |
| C. | 该有机物分子中至少有6个碳原子共平面 | |
| D. | 该有机物能与溴水发生加成反应且1mol该有机物最多能加成3mol的Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 方法 | 装置 | |
| ① | 氯化铵与熟石灰固体混合加热 | |
| ② | 浓氨水加热 | |
| ③ | 浓氨水滴加到固体烧碱上 |



查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com