
【题目】电解精炼锡后的阳极泥中除含有一定量的Sn外,还含有Ag、Bi、Cu等金属,极具回收价值。某锡冶炼厂采用纯湿法工艺从阳极泥中提取Ag、Bi、Cu,流程如下:

已知:①BiCl3+H2O![]() BiOCl+2HCl
BiOCl+2HCl
②SnO2不溶于稀酸和碱溶液
(1)锡阳极泥在“氧化浸出”前需粉碎处理,目的是__________________________。
(2)“氧化浸出"时Cu发生反应的离子方程式为______________________。
(3)浸渣1的主要成分为AgCl和SnO2,则“氨浸出“时发生反应的化学方程式为______________。
(4)水合肼(N2H4·H2O)起_________作用(填“还原”或“氧化”)。已知N2H4为二元弱碱,在水中的电离与氨相似,其第一步电离的方程式为________________________。
(5)粗银电解冶炼时用_________作阳极,用_________溶液作电解液。
(6)“沉铜铋”时应将溶液的pH调至0.5~1.0之间,目的是____________________。
【答案】 增大接触面积,加快浸出速率,提高浸出率 3Cu+ClO3-+6H+=3Cu2++Cl-+3H2O AgCl+2NH3·H2O=Ag(NH3)2Cl+2H2O 还原 N2H4+H2O![]() N2H5++OH- 粗银 AgNO3 抑制Cu2+、Bi3+的水解,有利于Cu、Bi的生成
N2H5++OH- 粗银 AgNO3 抑制Cu2+、Bi3+的水解,有利于Cu、Bi的生成
【解析】本题考查化学工艺流程,(1)氧化浸出前粉碎处理,其目的是增大接触面积,加快浸出速率,提高浸出率;(2)氧化浸出时,加入的物质为盐酸、NaClO3,利用NaClO3的氧化性,把Cu氧化为Cu2+,本身被还原成Cl-,然后根据化合价的升降法进行配平,即离子方程式为3Cu+ClO3-+6H+=3Cu2++Cl-+3H2O;(3)滤渣1的成分是AgCl和SnO2,氯化银与氨水发生络合反应,其化学反应方程式为AgCl+2NH3·H2O=Ag(NH3)2Cl+H2O;(4)根据流程图,加入水合肼后,得到粗银,Ag(NH3)2Cl中+1价Ag→0价,化合价降低,被还原,即水合肼为还原剂,N2H4为二元碱,在水中的电离与氨的相似,说明N2H4为二元弱碱,其第一步电离方程式为:N2H4+H2O ![]() N2H5++OH-;(5)粗银的电解冶炼原理与粗铜精炼原理相同,因此粗银作阳极,纯银作阴极,含有Ag+溶液作电解液,即AgNO3为电解质;(6)根据流程,得到Cu和Bi,因此调节pH至0.5~1.0目的是抑制Cu2+和Bi3+的水解,有利于Cu和Bi的生成。
N2H5++OH-;(5)粗银的电解冶炼原理与粗铜精炼原理相同,因此粗银作阳极,纯银作阴极,含有Ag+溶液作电解液,即AgNO3为电解质;(6)根据流程,得到Cu和Bi,因此调节pH至0.5~1.0目的是抑制Cu2+和Bi3+的水解,有利于Cu和Bi的生成。


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组用只含有铜、铝、铁的工业废料来制备硫酸铜和硫酸铝晶体,实验流程如下:
请回答:
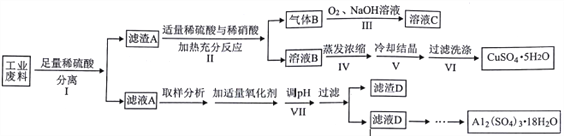
(1)步骤Ⅰ反应后分离操作可用下图所示方法,适用该方法分离的沉淀特点是___________________。
(2)写出步骤Ⅱ中发生反应的离子方程式___________________。写出步骤Ⅲ中气体B与O2(足量)通入NaOH溶液中反应的化学方程式___________________。
(3)步骤Ⅳ蒸发浓缩的具体操作是___________________。
(4)下列有关实验说法正确的是___________________。
A. 步骤Ⅴ为得到较大的硫酸铜晶体颗粒,可采用投入几粒晶种并加快溶液冷却速度的方法
B. 步骤Ⅵ过滤用如图装置,过滤结束时,为防止倒吸,可先关闭抽气泵,后打开活塞a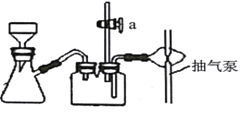
C. 步骤Ⅵ洗涤沉淀时,关小抽气泵,向布氏漏斗中加冰水没过沉淀,并用玻璃棒搅拌
D. 步骤Ⅶ调节pH时可加入氧化铝
(5)为测定实验所得硫酸铝晶体的纯度,进行以下实验:
步骤一:取晶体试样a g溶于20 mL水中,加适量醋酸-醋酸铵缓冲溶液,再加入过量的c1 mol·L-1 EDTA溶液V1 mL,充分反应后稀释至250mL。
步骤二:取25.00mL上述稀释液,滴加指示剂,用c2 mol·L-1 ZnCl2溶液滴定过量的EDTA, 达到终点时消耗V2 mL ZnCl2溶液。
已知:M[Al2(SO4)3·18H2O]=666g mol -1,EDTA分别能与Al3+ 或Zn2+ 以物质的量之比1:1进行反应。
根据实验数据计算该试样中Al2(SO4)3·18H2O的纯度为___________________(用含字母的代数式表示)。计算得出硫酸铝晶体的纯度为112.0%,若本测定实验操作正确且误差可忽略,分析纯度偏高的主要原因:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积可变的密闭容器中,反应2SO2(g)十O2(g) ![]() 2SO3(g)在一定条件下达到平衡,完成下列填空:
2SO3(g)在一定条件下达到平衡,完成下列填空:
(1)工业上该反应是在________(填设备名称)进行的,所用的催化剂是________。
(2)其他条件不变时,降低温度,平衡向正反应方向移动,则正反应为_______(选填“吸热”“放热”)。下图为反应速率(ν)与时间(t)的关系,判断在t1时刻曲线发生变化的原因是__________(选填编号)。

a.增大O2的浓度
b. 扩大容器体积
c. 加入催化剂
d. 升高温度
(3)改变条件后,平衡混合物中SO3的百分含量_______(选填“增大”“减小”“不变”)。
(4)工业上用氨水来吸收SO2尾气,最终形成化肥(NH4)2 SO4,将(NH4)2 SO4固体溶于水,溶液呈_______性,理由是____________________(用离子方程式表示),该溶液体系中存在多种守恒,请任写出其中一种守恒关系(用离子浓度表示) _______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】量取8.0 mL 5.0 mol·L-1 H2SO4溶液,加蒸馏水稀释至100 mL,取两份稀释后的H2SO4溶液各25 mL,分别加入等质量的Zn和Fe,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)。请计算:

(1)稀释后H2SO4溶液的物质的量浓度为________mol·L-1。
(2)加入Fe的质量至少有____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能发生的反应中,离子方程式正确的是
A. 硫酸与Ba(OH)2溶液混合:Ba2++OH-+H++SO![]() ===H2O+BaSO4↓
===H2O+BaSO4↓
B. 足量的氯气通入FeBr2溶液中:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
C. 碳酸钙和盐酸混合:CO![]() +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
D. MgCl2溶液中通入二氧化碳:Mg2++CO2+H2O===MgCO3↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将MgCl2·xH2O的晶体4.06g溶于水配成100mL溶液,此溶液50mL正好与50mL0.4mol/L的AgNO3溶液完全作用。由上述数据计算
(1)4.06g的MgCl2·xH2O物质的量______。
(2)式中x的数值______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述正确的是( )
A.所有物质里都含有化学键B.离子化合物中可能含有共价键
C.共价化合物中可能含有离子键D.水分子中的化学键是非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国沿海某城市采用反渗透法将海水淡化,得到淡水供市民使用,剩余母液继续加工获得其他产品。母液中主要含有Cl-、Na+、K+、Mg2+ 、Ca2+、SO42-、Br-等离子。某实验小组同学模拟工业生产流程,进行如下实验.

(1)写出实验室制备氯气的化学方程式_____________________;
(2)海水淡化的方法还有____________(写出一种);
(3)I中,电解饱和食盐水的工业生产叫做氯碱工业,写出该反应的离子方程式______;
(4)Cl2和Br2均为双原子分子,从原子结构的角度解释其原因_____________________;
(5)Ⅲ中,加入适量CaCl2固体的目的是_____________________;
(6)写出IV中反应的离子方程式_____________________;
(7)与过程II类似,工业上常用“空气吹出法”实现海水提溴,将1m3海水浓缩至1L,使用该法最终得到36g Br2,若提取率为60%,则原海水中溴的浓度为_________ mg/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com