
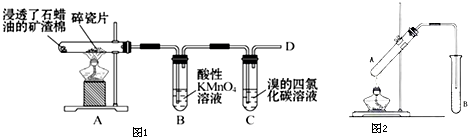
| 催化剂 |
| 催化剂 |


科目:高中化学 来源: 题型:阅读理解


| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
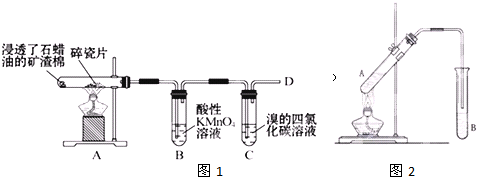
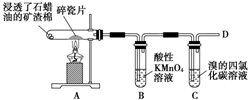 如图是石蜡油在炽热碎瓷片的作用下产生C2H4并检验C2H4性质的实验,完成下列各问题.
如图是石蜡油在炽热碎瓷片的作用下产生C2H4并检验C2H4性质的实验,完成下列各问题.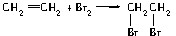
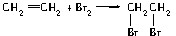
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)从图1-5-15中挑选所需的仪器,画出制取干燥NH3的装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置和尾气处理装置不用画),并标明所用试剂。
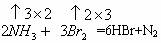
图1-5-15
(2)将NH3通入溴水中,有N2生成,反应的化学方程式为__________________。
(3)为验证:“同温同压下,相同体积的任何气体都含有相同的数目的分子”,该小组同学设计了如下图1-5-16所示的装置,图中B管的容积是A管的2倍。活塞K1、K2、K3、K4、K5均关闭(固定装置和尾气处理装置略;HCl和NH3均不溶于石蜡油,也不与之反应;装置气密性好)。
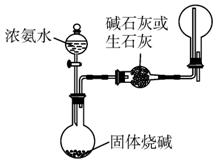
图1-5-16
①在A管中充满与大气压强相等的干燥HCl气体。操作是__________________。控制活塞K4、K5,调节C,使B管充满与A管同压的干燥NH3。
②缓慢开启活塞K3,A管中的现象是__________________。要达到实验目的,当反应完成并恢复到室温时,B管中预期的现象是__________;若观察不到预期现象,主要原因是_____________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com