解答:
解:(1)若A单质是重要的半导体材料,A为硅,B是光导材料的主要成分,B为二氧化硅,C的焰色反应呈黄色,水溶液呈碱性,是木材防火剂,C为硅酸钠,则X为氧气,Y为氢氧化钠,
①工业上用二氧化硅制备单质硅的化学方程式为SiO
2+2C
Si+2CO,
故答案为:SiO
2+2C
Si+2CO;
②A可与Y的热溶液反应放出最轻的气体和C,其反应的化学方程式为Si+2NaOH+H
2O═Na
2SiO
3+2H
2↑,
故答案为:Si+2NaOH+H
2O═Na
2SiO
3+2H
2↑;
(2)若A、B、C均为离子化合物,A常用作食品干燥剂,则A为氧化钙;X是一种固体单质且化合物种类繁多,则X为碳,B在常温下与Y快速反应得到白色糊状物C和一种气体,并放出大量热,则B为碳化钙,Y为水,C为氢氧化钙,
①CaC
2中阳离子与阴离子的个数比是1:1,
故答案为:1:1;
②工业中用氧化钙与碳在电炉中反应制备碳化钙并放出一种有毒气体为一氧化碳,已知1 mol A与X,反应吸收465.7 kJ的热量,写出该反应的热化学方程式为3C(s)+CaO(s)=CaC
2(s)+CO(g)△H=+465.7 kJ/mol,
故答案为:3C(s)+CaO(s)=CaC
2(s)+CO(g)△H=+465.7 kJ/mol;
(3)若A是常见的金属单质,Y是黄绿色气体单质,则A为铁,Y为氯气,B为氯化亚铁,X为盐酸,
①铁与盐酸反应,为了减缓反应速率而不影响该气体的总量,就要使溶液中氢子浓度降低,但产生氢气的氢离子总物质的量不变,所以可向盐酸溶液中加入适量的CH
3COONa(固)或 蒸馏水或NaCl溶液(相当于水的作用),而不能加KNO
3溶液,因为硝酸根离子有氧化性,加入之后不能产生氢气,也不能加CuSO
4(固),因为会构成原电池,加快反应速率,所以选ade,
故答案为:ade;
②将A与铜的混合金属投入到稀HNO
3溶液中,金属全部溶解,气体产物仅有NO,其体积为V
1L.继续向该溶液中滴加该HNO
3溶液,又产生V
2L的NO,第二次之所以NO产生,是因为第一次所得的溶液中有Fe
2+,与硝酸发生氧化还原反应,离子方程式为3Fe
2++4H
++NO
3-=NO+3Fe
3++2H
2O,根据氧化还原反应电子得失守恒可知,两次共产生V
1L+V
2L的NO,溶液中产生的阳离子所带正电荷的物质的量为
×3mol,所以反应最后溶液中硝酸根离子的物质的量为
×3mol,所以根据氮元素守恒,整个过程中所需HNO
3的物质的量为
×3mol+
mol=
mol,
故答案为:3Fe
2++4H
++NO
3-=NO+3Fe
3++2H
2O;
.

 A、B、C三种物质的转化关系如图所示(部分产物已略去)
A、B、C三种物质的转化关系如图所示(部分产物已略去)

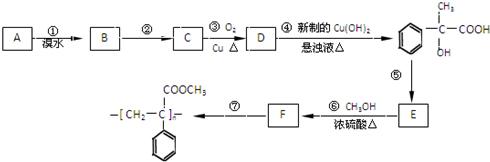
 ,回答下列问题:
,回答下列问题: