
 t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )
t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是( )| A. | 在t℃时,AgBr的Ksp为4.9×10-13 | |
| B. | 通过蒸发,可使溶液由a点变到c点 | |
| C. | 图中b点有AgBr沉淀析出 | |
| D. | 在t℃时,AgCl(s)+Br-(aq)?AgBr(s)+Cl-(aq)的平衡常数K≈816 |
分析 A.由图中c点可知Ksp(AgBr);
B.由a点变到c点,溴离子浓度不变,而蒸发时溴离子浓度增大;
C.b点在曲线的上方,Qc>Ksp;
D.t℃时,AgCl(s)+Br-(aq)?AgBr(s)+Cl-(aq)的平衡常数K=$\frac{c(C{l}^{-})}{c(B{r}^{-})}$=$\frac{Ksp(AgCl)}{Ksp(AgBr)}$.
解答 解:A.由图中c点可知Ksp(AgBr)=7×10-7×7×10-7=4.9×10-13,故A正确;
B.由a点变到c点,溴离子浓度不变,而蒸发时溴离子浓度增大,则不能通过蒸发实现由a点变到c点,故B错误;
C.b点在曲线的上方,Qc>Ksp,则b点有AgBr沉淀析出,故C正确;
D.t℃时,AgCl(s)+Br-(aq)?AgBr(s)+Cl-(aq)的平衡常数K=$\frac{c(C{l}^{-})}{c(B{r}^{-})}$=$\frac{Ksp(AgCl)}{Ksp(AgBr)}$=$\frac{4×1{0}^{-10}}{4.9×1{0}^{-13}}$=≈816,故D正确;
故选B.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握Ksp、K的计算、沉淀的生成为解答关键,侧重分析与应用能力的考查,注意选项B为易错点,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题

| A. | ①②③④均可与Na、NaOH、H2发生反应,1mol四种物质最多消耗Na、NaOH、H2的物质的量之比依次分别为1:1:1:1、1:2:2:1、4:3:3:5 | |
| B. | ①②③④属同分异构体,分子式为C8H8O3 | |
| C. | 可用银氨溶液或酸性KMnO4溶液区分③④ | |
| D. | ①②③④中所有原子均不可能处于同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
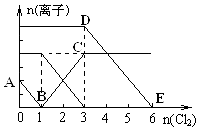 已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )
已知:2Fe3++2I-=2Fe2++I2,向1L含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.横、纵坐标的单位均为mol.有关说法不正确的是( )| A. | 线段BC代表Fe3+ 物质的量的变化情况 | |
| B. | 原混合溶液中c(FeBr2)=6 mol/L | |
| C. | 当通入Cl22mol时,溶液中已发生的反应可表示为2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| D. | 原溶液中n (Fe2+):n (I-):n(Br-)=2:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
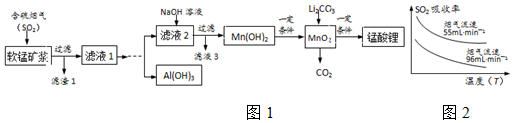
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 成分为盐酸的洁厕灵与84消毒液混合使用易中毒:Cl-+ClO-+2H+=Cl2↑+H2O | |
| B. | Na2O2与H2O反应:2O22-+2H2O=4OH-+O2↑ | |
| C. | NaHSO4溶液中滴入少量Ba(OH)2:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | FeI2溶液中滴入过量溴水:2Fe2++2I-+2Br2=2Fe3++I2+4Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 25℃时,将0.2mol•L?1 CH3COOH溶液逐滴滴入25mL某浓度的NaOH溶液中,
25℃时,将0.2mol•L?1 CH3COOH溶液逐滴滴入25mL某浓度的NaOH溶液中,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯甲酸易溶于水,可做食品防腐剂 | |
| B. | 提纯苯甲酸的过程中需要用到的玻璃仪器:烧杯、玻璃棒、漏斗 | |
| C. | 粗品中苯甲酸溶解后,还需再加入少量蒸馏水,以减少产品的损失 | |
| D. | 为了获得更多的苯甲酸,此实验中结晶温度越低越好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K2CO3(NH4Cl):加热 | |
| B. | CO2(SO2):饱和碳酸钠溶液、浓硫酸,洗气 | |
| C. | KCl溶液(BaCl2):加入适量K2SO4溶液,过滤. | |
| D. | 蛋白质(葡萄糖):浓Na2SO4溶液,盐析、过滤、洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题



| A. | 12.7% | B. | 25.4% | C. | 50.8% | D. | 76.2% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com