
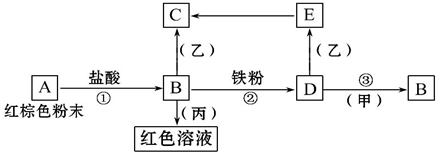
 下列物质之间有如下反应关系,已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色.
下列物质之间有如下反应关系,已知由E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色.分析 E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色,则E是Fe(OH)2、C是Fe(OH)3,A是红棕色粉末,能和盐酸反应生成B,则A是Fe2O3、B是FeCl3,B和丙反应生成红色溶液,则丙是KSCN,B和Fe反应生成D,则D是FeCl2,D和乙反应生成Fe(OH)2,则乙是NaOH等,D和甲反应生成FeCl3,则甲是Cl2.
解答 解:E转化成C的现象是:灰白色沉淀迅速变为灰绿色,最后变为红褐色,则E是Fe(OH)2、C是Fe(OH)3,A是红棕色粉末,能和盐酸反应生成B,则A是Fe2O3、B是FeCl3,B和丙反应生成红色溶液,则丙是KSCN,B和Fe反应生成D,则D是FeCl2,D和乙反应生成Fe(OH)2,则乙是NaOH等,D和甲反应生成FeCl3,则甲是Cl2.
(1)通过以上分析知,B为Fe2O3、D为FeCl2、甲为Cl2、丙为KSCN,
故答案为:Fe2O3;FeCl2;Cl2;KSCN;
(2)E→C反应的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
②反应的离子方程式:Fe+2Fe3+=3Fe2+,
③反应的离子方程式:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;Fe+2Fe3+=3Fe2+;2Fe2++Cl2=2Fe3++2Cl-.
点评 本题考查无机物推断,涉及Fe及其化合物性质与转化,物质的颜色及反应现象中颜色变化是推断突破口,掌握元素化合物性质以及铁离子、亚铁离子检验方法及现象,题目难度中等.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3- | |
| B. | 使酚酞变红色的溶液:Na+、Ba2+、HCO3-、Cl- | |
| C. | pH=7的溶液:Fe3+、K+、SO42-、Br- | |
| D. | 0.1mol/LNaAlO2溶液:Al3+、Na+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
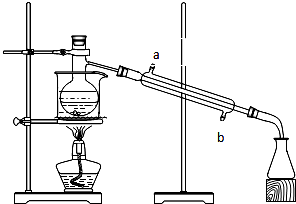 实验题:如图所示的仪器装置,在蒸馏烧瓶中装有冰醋酸、乙醇、浓硫酸和沸石,水浴加热,粗制乙酸乙酯.反应一段时间后,将粗产品倒入装有水的烧杯中,液体分为两层,现用两种方法检验
实验题:如图所示的仪器装置,在蒸馏烧瓶中装有冰醋酸、乙醇、浓硫酸和沸石,水浴加热,粗制乙酸乙酯.反应一段时间后,将粗产品倒入装有水的烧杯中,液体分为两层,现用两种方法检验查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Z>Y>X | |
| B. | Y元素在周期表中的位置为第三周期第ⅣA族 | |
| C. | X分别与Y、Z、W所形成的化合物均为共价化合物 | |
| D. | X与Y所形成的化合物的沸点可能高于X与Z所形成的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com