
| 2 |
| x |
| 1 |
| 100-96.64 |
| 6.72 |
| 7 |


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
 已知乙烯能发生以下转化:
已知乙烯能发生以下转化:查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为相互串联的甲、乙两电解池.试回答:
如图为相互串联的甲、乙两电解池.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、  :水分子; :水分子; :氯离子 :氯离子水合氯离子示意图 |
B、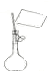 一定物质的量浓度溶液配制的某步操作 |
C、 MnO2和浓盐酸加热反应电子转移关系示意图 |
D、 丁达尔现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com