
(1)由金红石?TiO2?制取单质Ti,涉及到的步骤为:
TiO2 TiCl4
TiCl4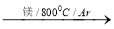 Ti
Ti
已知:① C?s?+O2?g?=CO2?g?; ?H=?393?5 kJ·mol?1
② 2CO?g?+O2?g?=2CO2?g?; ?H=?566 kJ·mol?1
③ TiO2?s?+2Cl2?g?=TiCl4?s?+O2?g?; ?H=+141 kJ·mol?1
则TiO2?s?+2Cl2?g?+2C?s?=TiCl4?s?+2CO?g?的?H= 。
(2)已知:①Zn(s)+1/2 O2(g)=ZnO(s);ΔH=-348.3 kJ/mol
②Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s);ΔH=-317.3 kJ/mol
则1 mol Ag(s)和足量O2(g)完全反应生成Ag2O(s)时,放出的热量为 kJ。
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.向稀HNO3中滴加Na2SO3溶液:SO32﹣+2H+=SO2↑+H2O
B.漂白粉溶液中通入足量二氧化硫气体:ClO﹣+SO2+H2O═HClO+HSO3-
C.NaHCO3溶液中加少量Ba(OH)2溶液:HCO3﹣+Ba2++OH﹣═BaCO3↓+H2O
D.向CuSO4溶液中加入Na2O2:2 Na2O2+2Cu2++2H2O═4Na++2Cu(OH )2↓+O2↑
)2↓+O2↑
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上11月考试化学卷(解析版) 题型:选择题
已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3-+H2O H2SO3+OH- ①
H2SO3+OH- ①
HSO3- H++SO32- ②
H++SO32- ②
向 0.1 mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
A.加入少量金属 Na,平衡①左移,平衡②右移,溶液中 c(HSO3-)增大
B.加入少量NaOH溶液,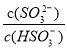 、
、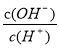 的值均增大
的值均增大
C.加入少量Na2SO3 固体,则 c(H+)+c(Na+)=c(HSO3-)+c(OH-)+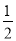 c(SO32-)
c(SO32-)
D.加入氨水至中性,则 2c(Na+)=c(SO32-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三上第四次月考化学卷(解析版) 题型:填空题
氮是地球上含量丰富的一种元素。氮及其化合物在在工农业生产、生活中有着重要作用。
(1)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)  2NH3(g),△H<0,其平衡常数K与温度t的关系如下表
2NH3(g),△H<0,其平衡常数K与温度t的关系如下表
T/K | 298 | 398 | 498 |
平衡常数K | 4.1 x 106 | K1 | K2 |
如果合成氨反应的方程式写为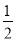 N2(g)+
N2(g)+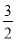 H2(g)
H2(g) NH3(g),其平衡常数为K’,则K’与K之间关系的数学表达式为_________________;根据已知条件可判定K1____________K2(填“>”“<”或“=”)
NH3(g),其平衡常数为K’,则K’与K之间关系的数学表达式为_________________;根据已知条件可判定K1____________K2(填“>”“<”或“=”)
(2)下列能说明合成氨反应已达到平衡状态的是___________(填序号)。(反应是在固定体积的密闭容器中进行的)
A.容器内温度保持不变
B.v正(N2)=3v逆(H2)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
(3)合成氨工业中,按照勒夏特列原理,工业生产中应采用的条件为高压、低温,但事实上反应中并未采用较低的温度,原因是_____________________。
(4)硝酸工业在国民经济、国防工业和航天事业中占有重要地位。随着化学纤维、近代有机合成、火箭、导弹等工业迅速发展,需要使用大量的硝酸。
①工业生产中用铂系金属作为催化剂,用氨氧化法制取硝酸。第一步反应为氨在催化剂作用下与氧气发生反应生成NO,写出反应的化学方程:________________________。
②铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将方程式表示为:Cu+HNO3 → Cu(NO3)2+NO↑+NO2↑+H2O (方程式未配平)。反应中的还原产物是_________________, 0.8mol Cu被硝酸完全溶解后,如果得到NO和NO2物质的量相同,那么标准状况下的气体体积为_________________L。(标况下NO和NO2视为气体)
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三上第四次月考化学卷(解析版) 题型:选择题
下列有关物质的量和阿伏加德罗常数的说法,不正确的是
A.0.6gCaCO3和Mg3N2的混合物中所含质子数为0.3NA
B.常温常压下,22.4LCH4中所含原子数小于5NA
C.含有0.2molH2SO4的浓硫酸与足量铜加热条件下反应,转移的电子数一定小于0.2NA
D.标准状况下,22.4L苯所含碳原子的物质的量是6mol
查看答案和解析>>
科目:高中化学 来源:2017届山东省东营市高三上期中化学卷(解析版) 题型:选择题
按下图所示装置进行实验,若x轴表示流入阴极的电子的物质的量,则y轴应表示( )
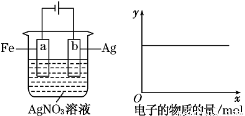
①c(Ag+) ②c(NO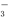 ) ③a棒的质量
) ③a棒的质量
④b棒的质量 ⑤c(H+)
A.①③ B.③④ C.①②④ D.①②⑤
查看答案和解析>>
科目:高中化学 来源:2017届山东省东营市高三上期中化学卷(解析版) 题型:选择题
目前人们正研究开发一种高能电池——钠硫电池,它是以熔融的钠、硫为两极,以Na+ 导电的β—Al2O3陶瓷作固体电解质,反应如下:2Na+xS  Na2Sx,以下说法正确的是( )
Na2Sx,以下说法正确的是( )
A.放电时,钠作正极,硫作负极
B.放电时,钠极发生还原反应
C.充电时,钠极与外电源正极相连,硫极与外电源的负极相连
D.充电时,阳极发生的反应是Sx 2--2e-= xS
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期统练三化学试卷(解析版) 题型:填空题
利用电化学原理可以解决很多问题。
(1)精确测量金属离子在惰性电极上以镀层形式沉积的金属质量,可以确定电解过程中通过电解池的电量。实际测量中常用的银电量计结构如图所示。

①电量计中的银棒应与电源的正极相连,铂坩埚上发生的电极反应是_____________;
②实验中,为了避免银溶解过程中可能产生的金属颗粒掉进铂埚而导致测量误差,常在银电极附近增加一个收集网袋。若没有收集网袋,测量结果会____________(填“偏高"“偏低”或“无影响”);
③若要测定电解精炼铜时通过的电量,可将该银电量计中的银棒与待测电解池的________电极相连。
(2)如图所示,将铁棒和石墨棒插人盛有饱和NaCl溶液的U型管中。
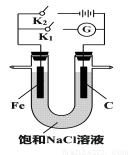
①K1闭合,铁棒上发生的反应为______________;
②K2闭合,铁棒不会被腐蚀,属于_________保护法。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一上期中化学卷(解析版) 题型:选择题
在实验室,称取一定量的粗盐经溶解、过滤、结晶等操作,可得到较纯净的食盐。下列图示对应的操作不规范的是
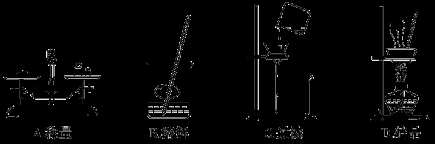
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com