
分析 (1)次氯酸根离子能够将碘离子氧化为碘单质,本身被还原为氯离子,据电子守恒和原子守恒配平离子方程式;
(2)在反应Na2SO3+I2+H2O═Na2SO4+2HI中,1molNa2SO3中S转移电子为2mol,1molI2中I转移电子是2mol,据此分析;
(3)据氧化还原反应中氧化剂的氧化性大于氧化产物分析.
解答 解:(1)ClO-转化成Cl-化合价降低2价,I-转化成I2,化合价至少升高2价,则次氯酸根离子和碘单质的系数都是1,然后利用观察法配平可得:2H++2I-+ClO-=Cl-+H2O+I2,
故答案为:2H+;1;2;1;1;1;H2O;
(2)1molNa2SO3中S转移电子为2mol,1mol I2转化成HI转移电子是2mol,用双线桥法表示电子得失的方向和数目为: ,
,
故答案为: ;
;
(3)次氯酸根离子能够将碘离子氧化为碘单质,次氯酸根离子的氧化性比碘单质强,碘单质能够将氧化亚硫酸钠氧化为硫酸钠,碘单质的氧化性比
硫酸根离子强,所以SO42-、I2和CIO-的氧化性有强到弱的顺序是ClO->I2>SO42-,
故答案为:ClO->I2>SO42-.
点评 本题考查氧化还原反应方程式的书写、电子转移的表示以及氧化剂氧化性强弱的比较,题目难度中等,明确氧化还原反应的实质为解答关键,注意掌握氧化性、还原性强弱的比较方法,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
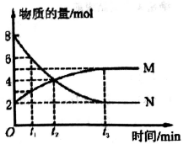 一定温度下,在体积为2L的密闭容器中通入气体M和N并发生反应,物质的量随时间的变化关系如图.下列说法正确的是( )
一定温度下,在体积为2L的密闭容器中通入气体M和N并发生反应,物质的量随时间的变化关系如图.下列说法正确的是( )| A. | M、N之间转化的反应方程式为M=2N | |
| B. | t2时刻,反应达到平衡,正、逆反应速率达到相等 | |
| C. | t3时刻,M的反应速率为$\frac{3}{2{t}_{3}}$mol•L-1•min-l | |
| D. | t1时刻,在容器内气体M和N的物质的量浓度之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
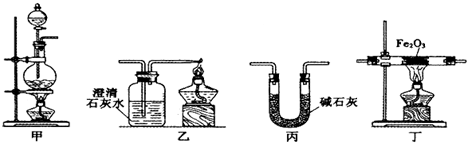
| 加热方式 | 通CO加热 时间/min | 澄清石灰水变 浑浊时间/min | 产物颜色 | 产物能否全部 被磁铁吸引 |
| 酒精灯 | 30 | 5 | 黑色 | 能 |
| 酒精喷灯 | 30 | 1 | 黑色 | 能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2+3H2 $?_{高温高压}^{催化剂}$2NH3 | B. | 2C2H2+5O2$\frac{\underline{\;点燃\;}}{\;}$2H2O+4CO2 | ||
| C. | Cl2+H2$\frac{\underline{\;点燃\;}}{\;}$2HCl | D. | C2H4+H2$\frac{\underline{\;催化剂\;}}{\;}$C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成物总能量一定低于反应物总能量 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 键能越大,物质越稳定,断键所需的能量就越大 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的所放出的热量不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4、NaOH、NaNO3都是强电解质 | B. | Na2O、Al2O3、Fe2O3都是碱性氧化物 | ||
| C. | 铝土矿、小苏打都是混合物 | D. | 烧碱、纯碱、熟石灰都是碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCL(aq)$\stackrel{CO_{2}}{→}$NaHCO3(s)$\stackrel{△}{→}$NaCO3(s) | |
| B. | FeSz$→_{燃烧}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | SiO2$\stackrel{HCl(aq)}{→}$SiCl4$→_{高温}^{H_{2}}$Si | |
| D. | N2$→_{高温、高压、催化剂}^{H_{2}}$NH3$\stackrel{HCl(aq)}{→}$NH4Cl(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
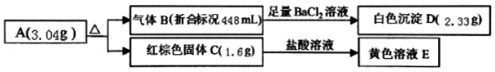
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com