
 CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.
CO2和CH4是两种重要的温室气体,通过CH4和CO2反应制造更高价值化学品是目前的研究目标.分析 (1)①恒温恒压,折算等比,属于等效平衡;
②根据盖斯定律来解答;
(2)①根据温度对催化剂活性的影响;
②根据外界条件对化学平衡的影响,平衡正向移动,反应物转化率增大.
解答 解:(1)①恒压的密闭容器中起始充入4mol CO2、1mol CH4,达到平衡后,再充入4mol CO2、1mol CH4,相当于一次性充入8mol CO2、2mol CH4,反应物比值为2:1,恒温恒压,折算后与原平衡投料等比,属于等效平衡,CO的体积分数不变,
故答案为:不变;
②CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 ①
CO(g)+H2O (g)=CO2(g)+H2 (g)△H=2.8kJ•mol-1 ②
2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1 ③
根据盖斯定律,由①+②×2-③×2得,CO2(g)+CH4(g)?2CO(g)+2H2(g)△H=-890.3kJ•mol-1+2.8kJ•mol-1×2+566.0kJ•mol-1×2=+247.3 kJ•mol-1,
故答案为:+247.3 kJ•mol-1;
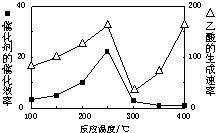
(2)①温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,
故答案为:温度超过250℃时,催化剂的催化效率降低;
②CO2和CH4直接转化成乙酸是一个气体体积缩小的反应,增大反应压强、增大CO2的浓度,平衡正向移动,反应物转化率增大,
故答案为:增大反应压强、增大CO2的浓度.
点评 本题考查等效平衡、盖斯定律、化学平衡的影响因素,注意等效平衡的应用,恒温恒压折算等比即可判断,题目难度适中.


科目:高中化学 来源: 题型:选择题
| A. | 光导纤维应避免在强碱环境中使用 | |
| B. | 船体镀锌或镀锡均可保护船体,镀层破损后将立即失去保护作用 | |
| C. | 部分卤代烃可用作灭火剂 | |
| D. | 油脂皂化生成的高级脂肪酸钠是肥皂的有效成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的种类由原子核内质子数、中子数决定 | |
| B. | 元素的种类由原子核内质子数、中子数决定 | |
| C. | 32He代表原子核内有2个质子和3个中子的氦原子 | |
| D. | 178O和188O原子的核外电子数是前者大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热或点燃H2、CO、CH4等可燃性气体参与反应时,都要先检验纯度再加热或点燃. | |
| B. | 将SO2通入酸性高锰酸钾溶液中,紫红色褪去,说明SO2具有漂白性 | |
| C. | KNO3与NaCl的混合物,通过结晶法一次分离就可得到两种纯净物 | |
| D. | 检验硫酸亚铁铵溶液中Fe2+的方法是:先滴加新制氯水,后滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列“试剂”和“试管中的物质”不能完成“实验目的”的是( )
下列“试剂”和“试管中的物质”不能完成“实验目的”的是( ) | 实验目的 | 试剂 | 试管中的物质 | |
| A | 浓度对硫酸的性质有影响 | Fe | ①稀硫酸;②浓硫酸 |
| B | 羟基对苯环活性有影响 | 饱和溴水 | ①苯;②苯酚 |
| C | 甲基对苯环活性有影响 | 酸性KMnO4溶液 | ①苯;②甲苯 |
| D | 碳酸钠溶液碱性比碳酸氢钠溶液强 | 酚酞溶液 | ①碳酸钠溶液 ②碳酸氢钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a为H2S,SO2+2H++S2-→3 S↓十2H2O | |
| B. | a为Cl2,Ba2++SO2+2 H2O+Cl2→BaSO3↓+4H++2Cl- | |
| C. | a为NO2,4Ba2++4SO2+5H2O+NO3-→4 BaSO4↓+NH4++6 H+ | |
| D. | a为NH3,Ba2++SO2+2 NH3+2H2O→BaSO4↓+2NH4++2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com