
| A. | 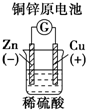 | B. | 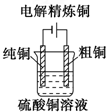 | C. | 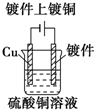 | D. | 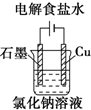 |
分析 A.原电池中,较活泼的金属作负极,较不活泼的金属或导电的非金属作正极;
B.电解精炼铜时,粗铜作阳极,纯铜作阴极,电解质溶液中含有铜离子;
C.电镀时,镀层作阳极,镀件作阴极;
D、电解氯化铜溶液,石墨作阳极时,阳极上氯离子放电,阴极上铜离子放电.
解答 解:A.该原电池中,较活泼的金属锌作负极,较不活泼的金属铜作正极,故A正确;
B.电解精炼铜时,粗铜作阳极,阳极上铜失电子发生氧化反应,纯铜作阴极,阴极上铜离子得电子发生还原反应,故B正确;
C.电镀时,镀层铜作阳极,镀件作阴极,电解过程中,铜离子在阴极析出,故C错误;
D.电解氯化铜溶液时,惰性电极作阳极,则阳极上氯离子放电生成氯气,无论阴极是否活泼,阴极上都是铜离子得电子生成铜,故D正确.
故选C.
点评 本题考查了原电池和电解池原理,注意电解时,如果阳极是活泼电极,则阳极上是电极材料放电而不是溶液中阴离子放电,为易错点.


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用氨水除去试管内壁上的银镜 | |
| B. | 利用乙酸乙酯和乙醇的密度不同,可用分液的方法分离 | |
| C. | 用燃烧法鉴别乙醇、苯和四氯化碳 | |
| D. | 用氢氧化钠溶液鉴别乙醇、乙酸和乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
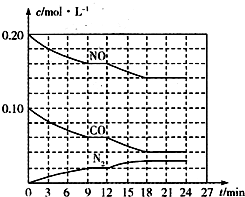 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要. )+c(HSO
)+c(HSO )(用含硫微粒浓度的代数式表示).
)(用含硫微粒浓度的代数式表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮及其化合物与人类生产、生活息息相关.回答下列问题:
氮及其化合物与人类生产、生活息息相关.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
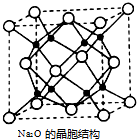
 常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,已知0-t1时,原电池的负极是Al片,反应过程中有红棕色气体产生.下列说法不正确的是( )
常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(如图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,已知0-t1时,原电池的负极是Al片,反应过程中有红棕色气体产生.下列说法不正确的是( )| A. | 0-t1时,正极的电极反应式为:2H++NO3--e-═NO2+H2O | |
| B. | 0-t1时,溶液中的H+向Cu电极移动 | |
| C. | t1时,负极的电极反应式为:Cu-2e-═Cu2+ | |
| D. | t1时,原电池中电子流动方向发生改变是因为Al在浓硝酸中钝化,氧化膜阻碍了Al的进一步反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将金属A投入B的盐溶液,A溶解说明A的金属性比B的金属性强 | |
| B. | 用干燥洁净的铂丝蘸取少量待测液在酒精灯火焰上灼烧,火焰呈黄色,说明该溶液是钠盐溶液 | |
| C. | 合成新型农药可以在元素周期表的金属与非金属交界处区域探寻 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2 ml 5%H2O2和1 mlH2O,向另一支试管中加入2 mL 5%H2O2和1 mLFeCl3溶液,观察并比较实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
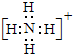
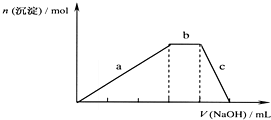
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com