
【题目】乙醇(C2H5OH)是生活中常见的物质,下图给出了乙醇的结构式和球棍模型。

I.乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。
碱性乙醇燃料电池 酸性乙醇燃料电池 熔融盐乙醇燃料电池
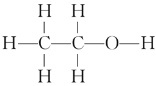
(1)三种乙醇燃料电池中正极反应物均为_______。(填化学式)
(2)碱性乙醇燃料电池中,电极a上发生的电极反应式为_______,使用空气代替氧气,电池工作过程中碱性会不断下降,其原因是_______。
(3)酸性乙醇燃料电池中,电极b上发生的电极反应式为_______。
(4)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向电极_______(填“a”或“b”)移动。
II. 已知气相直接水合法可以制取乙醇:H2O(g)+C2H4(g)![]() CH3CH2OH(g)。当n(H2O):n(C2H4)=1:1时,乙烯的平衡转化率与温度、压强的关系如下图:
CH3CH2OH(g)。当n(H2O):n(C2H4)=1:1时,乙烯的平衡转化率与温度、压强的关系如下图:
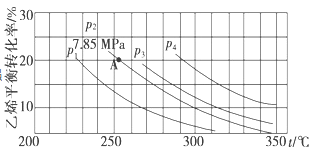
(1)图中压强p1、p2、p3、p4的大小顺序为:_______,理由是:_______。
(2)气相直接水合法采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290℃,压强6.9 MPa,n(H2O):n(C2H4)=0.6:1。该条件下乙烯的转化率为5%。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有_______、_______。
【答案】O2 C2H5OH+16OH--12e-=2CO32-+11H2O 空气中的CO2会与KOH溶液反应,降低溶液的碱性,同时反应中也会消耗KOH 3O2+12H++12e-=6H2O a p4>p3>p2>p1 反应为气体体积减小的反应,增大压强平衡正向移动,乙烯的转化率增大,所以相同条件下,转化率越大的代表压强越大 其他条件不变,增加H2O(g)的浓度 其他条件不变,移出生成物
【解析】
I. (1)燃料电池中通入燃料的为负极,通入氧气或空气的为正极,三种乙醇燃料电池中正极反应物均为氧气;
(2)碱性乙醇燃料电池中,电极a为负极,电极反应式为C2H5OH+16OH--12e-=2CO32-+11H2O,使用空气代替氧气 ,空气中的CO2会与KOH溶液反应,降低溶液的碱性,同时反应中也会消耗KOH;
(3)酸性乙醇燃料电池中,电极b为正极,电极反应式为3O2+12H++12e-= 6H2O;
(4)根据图示,a为负极,原电池中阴离子由正极向负极移动,CO32-向电极a移动;
Ⅱ.(1)在相同温度下由于乙烯转化率为p1<p2<p3<p4,由C2H4(g)+H2O(g)![]() C2H5OH(g)可知正反应为气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是p1<p2<p3<p4;
C2H5OH(g)可知正反应为气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是p1<p2<p3<p4;
(2)若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以改变物质的浓度,如从平衡体系中将产物乙醇分离出来,或增大水蒸气的浓度等。据此解答。
I. (1)燃料电池中通入燃料的为负极,通入氧气或空气的为正极,三种乙醇燃料电池中正极反应物均为氧气。本小题答案为:O2。
(2)碱性乙醇燃料电池中,电极a为负极,电极反应式为C2H5OH+16OH--12e-=2CO32-+11H2O,使用空气代替氧气 ,空气中的CO2会与KOH溶液反应,降低溶液的碱性,同时反应中也会消耗KOH。本小题答案为:C2H5OH+16OH--12e-=2CO32-+11H2O;空气中的CO2会与KOH溶液反应,降低溶液的碱性,同时反应中也会消耗KOH。
(3)酸性乙醇燃料电池中,电极b为正极,电极反应式为3O2+12H++12e-= 6H2O。本小题答案为:3O2+12H++12e-= 6H2O。
(4)根据图示,a为负极,原电池中阴离子由正极向负极移动,CO32-向电极a移动。本小题答案为:a。
Ⅱ.(1)在相同温度下由于乙烯转化率为p1<p2<p3<p4,由C2H4(g)+H2O(g)![]() C2H5OH(g)可知正反应为气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是p1<p2<p3<p4。本小题答案为:p1<p2<p3<p4;反应为气体体积减小的反应,增大压强平衡正向移动,乙烯的转化率增大,所以相同条件下,转化率越大的代表压强越大。
C2H5OH(g)可知正反应为气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是p1<p2<p3<p4。本小题答案为:p1<p2<p3<p4;反应为气体体积减小的反应,增大压强平衡正向移动,乙烯的转化率增大,所以相同条件下,转化率越大的代表压强越大。
(2)若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以改变物质的浓度,如从平衡体系中将产物乙醇分离出来,或增大水蒸气的浓度等。本小题答案为:其他条件不变,增加H2O(g)的浓度;其他条件不变,移出生成物。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下表是中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题。
| IA | 0 | |||||||
1 | ① | II A | III A | IV A | V A | VI A | VIIA | ||
2 | ② | ③ | Ne | ||||||
3 | ④ | ⑤ | Al | S | ⑥ | ||||
(1)②表示的元素名称是____________;
(2)⑥的原子结构示意图是______________;
(3)由①和③两种元素组成的化合物的电子式是___________;
(4)②和③中,最高价氧化物对应的水化物酸性最强的酸的化学式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种新型液硫二次电池,其工作原理如图所示。下列说法错误的是
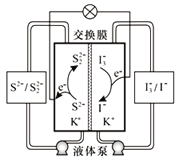
A. 放电时,电池左侧为负极,发生氧化反应
B. 充电时,电解质溶液中K+经交换膜向右侧移动
C. 放电时,电池右侧的电极反应为I3-+2e-=3I-
D. 充电时,电池的总反应为S22-+3I-![]() 2S2-+I3-
2S2-+I3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830℃时,向一个2 L的密闭容器中充入0.2 mol的A和0.8 mol的B,反应初始4 s内A的平均反应速率υ(A)=0.005 mol/(L·s)。下列说法正确的是
A. 4 s时c(B)为0.38 mol/L
B. 830℃达平衡时,A的转化率为20%
C. 反应达平衡后,升高温度,平衡正向移动
D. 1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数为0.4
A(g)+B(g)的平衡常数为0.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含氮污染物的治理是环保的一项重要工作。合理应用和处理氮的化合物,在生产生活中有重要意义。
(1)已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJmol﹣1
2C(s)+O2(g)=2CO(g) △H=﹣221.0kJmol﹣1
C(s)+O2(g)=CO2(g) △H=﹣393. 5kJmol﹣1
则汽车尾气处理的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=_____ kJmol﹣1,利于
该反应自发进行的条件是_______(选填“高温”或“低温”)。

(2)将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中发生反应:
2NO(g)+2CO(g)N2(g)+2CO2(g),反应过程中 部分物质的浓度变化如图所示:
反应从开始到9min时,用CO2表示该反应的速率是____________________(保留2位有效数字)
②第12min时改变的条件是______________(填“升温或降温”).
③第18min时建立新的平衡,此温度下的平衡常数为______________(列计算式),第24min时,若保持温度不变,再向容器中充入CO和N2各0.060mol,平衡将_____移动(填“正向”、“逆向”或“不”)。
(3)若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在t1时刻达到平衡状态的是________________(填序号)。
(如图中v正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
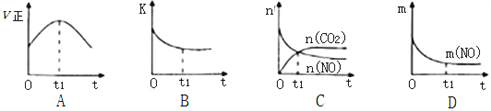
(4)以氨为燃料可以设计制造氨燃料电池,产物无污染。若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、磷元素在化学中有很重要的地位,硼、磷及其化合物广泛应用于开发新型储氢材料、超导材料、富燃料材料、复合材料等高新材料领域。回答下列问题。
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Ti3+的未成对电子数有___个。
②LiBH4由Li+和BH4-构成,BH4-呈正四面体构型。LiBH4中不存在的作用力有___(填标号)
A.离子键 B.共价键 C.金属键 D.配位键
(2)氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键,则氨硼烷分子结构式为____,写出一种与氨硼烷互为等电子体的分子___(填化学式)。
(3)硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子间通过氢键相连[如图]。

读图分析1mol H3BO3的晶体中有___mol氢键。
(4)四(三苯基膦)钯分子结构如图:

P原子以正四面体的形态围绕在钯原子中心上,钯原子的杂化轨道类型为___;判断该物质在水中___(填写“易溶”或者“难溶”),并加以解释____。
(5)硼氢化钠是一种常用的还原剂。其晶胞结构如图所示:

①该晶体中Na+的配位数为___。
②已知硼氢化钠晶体的密度为ρg/cm3,NA代表阿伏伽德罗常数的值,则a=___(用含ρ、NA的最简式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有80多种元素,是重要的物质资源宝库,同时海水具有强大的自然调节能力,为解决环境污染问题提供了广阔的空间。
(1)①已知不同pH条件下,水溶液中碳元素的存在形态如下图所示。

下列说法不正确的是_____________ (填字母序号)。
a. pH=8时,溶液中含碳元素的微粒主要是HCO3-
b. A点,溶液中H2CO3和HCO3-浓度相同
c. 当c(HCO3-)=c(CO32-)时,c(H+)>c(OH-)
②向上述pH=8.4的水溶液中加入NaOH溶液时发生反应的离子方程式是_____________。
(2)海水pH稳定在7.9~8.4之间,可用于烟道气中CO2和SO2的吸收剂。
①海水中含有的OH-可以吸收烟道气中的CO2,同时为海水脱钙,生产CaCO3。写出此反应的离子方程式:_____________。
②已知:25℃时,H2CO3电离平衡常数K1=4.3×10-7 K2=5.6×10-11
H2SO3电离平衡常数K1=1.5×10-2 K2=6.0×10-8
海水中含有的HCO3-可用于吸收SO2,该过程产物中有CO2和_____________。
(3)洗涤烟气后的海水呈酸性,需处理后再行排放。与新鲜海水混合同时鼓入大量空气排出部分CO2,是一种处理的有效方式。
①通入O2可将酸性海水中的硫(IV)氧化,该反应的离子方程式是_____________。
②上述方式使处理后海水pH升高的原因是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃在一定条件下发生氧化反应,碳碳双键断裂,如:![]() 被氧化为
被氧化为![]() 和
和![]()
![]() 、
、![]() 、
、![]() 、
、![]() 表示烃基或氢原子
表示烃基或氢原子![]() 。由此推断分子式为
。由此推断分子式为![]() 的烯烃所有可能的氧化产物有( )
的烯烃所有可能的氧化产物有( )
A. 5种B. 6种C. 7种D. 8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于氧化还原反应的是( )
A.H2+Cl2=2HCl
B.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
C.NH4HCO3![]() NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O
D.Zn+H2SO4=H2↑+ZnSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com