
已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,B、C同周期,D、E也同周期,D原子最外层电子数与最内层电子数相等,A、B、C、D的原子序数之和是E的两倍,D与C形成的化合物是一种耐高温材料,A、B形成的气态化合物的水溶液呈碱性。下列说法正确的是( )
A. 原子半径:D>E>C>B>A
B. 热稳定性:EA4>A2C
C. 单质D可用海水作原料获得
D. 化合物DC与化合物EC2中化学键类型相同
科目:高中化学 来源:2016-2017学年遵义市高二上学期期中考试化学(文)试卷 题型:选择题
下列变化过程需加入氧化剂的是
A.HCl→H2
B.Mg→Mg2+
C.Cl-→AgCl
D.CuO→Cu
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一10月月考化学试卷(解析版) 题型:选择题
将一质量分数为ω的KOH溶液蒸发掉m g水后,质量分数恰好变为2ω,体积为V(溶液中无晶体析出),则浓缩后溶液的物质的量浓度为
A.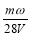 mol·L-1 B.
mol·L-1 B.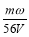 mol·L-1 C.
mol·L-1 C.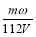 mol·L-1 D.
mol·L-1 D.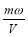 mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源:2017届安徽省高三上第二次月考化学试卷(解析版) 题型:填空题
[化学——选修3:物质结构与性质]利用元素周期表中同族元素的相似性,可预测元素的性质。
(1)写出P元素的基态原子的核外电子排布式:__________,P元素的基态原子有_________个未成对电子。
(2)白磷的分子式为P4,其结构如下图所示。
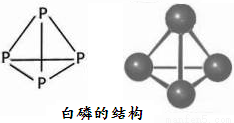
科学家目前合成了 N4分子,在N4分子中N原子的杂化轨道类型是___________,N—N键的键角为_____________
(3)N、P、As原子的第一电离能由大到小的顺序为_____________。
(4)立方氮化硼晶体的结构如下图所示:
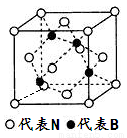
立方氮化硼晶体中,每个晶胞中B原子的个数为_____________。
(5)N与As是同族元素,B与Ga是同族元素,立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是____________;立方砷化镓晶体的晶胞边长为a pm(1pm=1×10-12m),则其密度为____________g·cm-3(用含a的式子表示,设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源:2017届安徽省高三上第二次月考化学试卷(解析版) 题型:选择题
Fe和Mg与H2SO4反应的实验如下:
实验 |
|
|
|
|
现象 | Fe表面产生大量无色气泡 | Fe表面产生气泡后迅速停止 | Mg表面迅速产生大量气泡 | Fe表面有大量气泡,Mg表面有少量气泡 |
关于上述实验说法不合理的是( )
A.I中产生气体的原因是:Fe + 2H+=Fe2++ H2↑
B.取出Ⅱ中的铁棒放入CuSO4溶液立即析出亮红色固体
C.Ⅲ中现象说明Mg在浓H2SO4中没被钝化
D.Ⅳ中现象说明Mg的金属性比Fe强
查看答案和解析>>
科目:高中化学 来源:2017届安徽省高三上第二次月考化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下的22.4L氯气与27g铝充分反应,转移电子数为3NA
B.标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数为1.5 NA
C.7.8 g Na2O2含有的阴离子数目为0.1 NA
D.80mL10mol/L的浓盐酸与足量MnO2反应,转移电子数为0.4NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都市高一上学期10月月考化学试卷 题型:填空题
今有10种物质:①Cu②稀硫酸③醋酸④NH3 ⑤空气⑥CO2⑦Fe(OH)3胶体⑧NaCl⑨BaSO4⑩碘酒按信息用番号填空。
⑤空气⑥CO2⑦Fe(OH)3胶体⑧NaCl⑨BaSO4⑩碘酒按信息用番号填空。
(1)能导电的物质;(2)电解质,但熔融状态下并不导电;
(3)强电解质;(4)非电解质。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都市高二10月阶段性考试化学试卷 题型:填空题
碳和氮是动植物体中的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容。
(1)已知2.00g的C2H2完全燃烧生成液态水和二氧化碳气体放出99.6kJ热量,写出表示C2H2燃烧热的热化学方程式。
(2)利用上述反应设计燃料电池(电解质溶液为氢氧化钾溶液),写出电池负极的电极反应式。
(3)用活性炭还原法处理氮氧化物,有关反应为:C(s)+2NO(g) N2(g)+CO2(g)。某研究小组向一个容器容积为3L且容积不变的密闭真空
N2(g)+CO2(g)。某研究小组向一个容器容积为3L且容积不变的密闭真空 容器(固体试样体积忽略不计)中加入NO和足量的活性炭,在恒温(T1℃)条件下反应,测得不同时间(t)时各物质的物质的量(n)如表:
容器(固体试样体积忽略不计)中加入NO和足量的活性炭,在恒温(T1℃)条件下反应,测得不同时间(t)时各物质的物质的量(n)如表:
物质 n/mol t/min | NO | N2 | CO2 |
0 | 2.00 | 0 | 0 |
10 | 1.16 | 0.42 | 0.42 |
20 | 0.80 | 0.60 | 0.60 |
30 | 0.80 | 0.60 | 0.60 |
①10min~20min以v(NO)表示的反应速率为。
②下列各项能判断该反应达到平衡状态的是(填序号字母)。
A.v(NO)(正)=2v(N2)(逆)B.容器内CO2和N2的体积比为1:1
C.混合气体的平均相对分子质量保持不变D.容器内压强保持不变
E.混合气体的密度保持不变
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率(填“增大”、“不变”或“减小”)。
(4)在3L容积可变的密闭容器中发生上述反应:H2(g)+CO2(g) H2O(g)+CO(g),恒温下c(CO)随反应时间t变化的曲线Ⅰ如下图所示。
H2O(g)+CO(g),恒温下c(CO)随反应时间t变化的曲线Ⅰ如下图所示。

①若在t0时改变一个条件,使曲线Ⅰ变成曲线Ⅱ,则改变的条件是________;
②若在t0时刻将容器体积快速压缩至2L(其他条件不变),请在下图中画出c(CO)随反应时间t变化的曲线。

(5)已知:CO(g)+H2O(g) H2(g)+CO2(g)△H=-41.2kJ/mol,850℃时在一体积为10L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如右图所示:下列说法正确的是(填序号)
H2(g)+CO2(g)△H=-41.2kJ/mol,850℃时在一体积为10L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如右图所示:下列说法正确的是(填序号)
A.达到平衡时,氢气的物质的量是0.12mol
B.达到平衡时,反应体系最终会放出49.44kJ热量
C.第6min时,若升高温度,反应正向移动
D.第8min时,若充入氦气,会导致v正(CO)<v逆(H2O)
(6)下图表示在温度分别为T1、T2时,平衡体系中CO的体积分数随压强变化曲线,A、C两点的反应速率AC(填“>”、“=”或“<”,下同),由状态B到状态A,可采用的方法(填“升温”或“降温”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期第二次月考化学试卷 题型:计算题
3.24g淀粉和3.42g蔗糖混合,在一定条件下水解(假设完全水解),若得到ag葡萄糖和bg果糖,则a与b的比值是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com