
【题目】用NA表示阿伏加德罗常数的值,下列说法错误的是
A.常温常压下,9.5g羟基(—18OH)中所含中子数为5NA
B.室温下,1LpH=13的NaOH溶液中,由水电离的OH-数目为0.1NA
C.2molFeBr2与足量氯气反应时,转移的电子数为6NA
D.甲烷燃料电池的正极消耗22.4LO2(标准状况下),电路中通过的电子数为4NA
【答案】B
【解析】
A.1个(—18OH)含有18-8+0=10个中子;—18OH的摩尔质量为19g/mol,所以9.5g羟基(-18OH)含有的中子数为![]() =5mol,即5NA,故A正确;
=5mol,即5NA,故A正确;
B.1LpH=13的NaOH溶液中n(H+)=10-13mol/L×1L=10-13mol,水电离出的氢离子和氢氧根数量相同,所以水电离出的OH-数目为10-13NA,故B错误;
C.2molFeBr2与足量氯气反应时,Fe2+被氧化成Fe3+,化合价升高1价,Br-被氧化成Br2,化合价升高1价,2molFeBr2含有2molFe2+和4molBr-,所以转移6mol电子,故C正确;
D.甲烷燃料电池中氧气作为正极原料被还原成-2价,所以每个氧分子得到4个电子,标况下22.4L氧气的物质的量为1mol,所以转移的电子为4mol,即4NA,故D正确;
故答案为B。


科目:高中化学 来源: 题型:
【题目】为探究同主族非金属元素性质的递变规律,某研究性学习小组的甲同学设计了如图所示的实验装置,其中A装置内可生成Cl2。
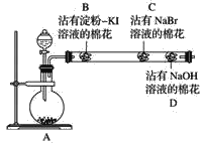
(1)甲同学的部分实验记录如下:B处棉花变成蓝色;C处棉花变成橙红色。甲同学由此现象得出的结论是同主族从上到下元素的非金属性减弱。
①B处发生反应的化学方程式为_________。
②甲同学的结论是________(填“正确”或“不正确”)的,理由是____________________。
(2)乙同学认为应将甲同学实验中B、C两处的棉花调换位置,用氯气先置换出溴,然后溴再与KI接触,以判断Br2与KI能否发生反应。该设想是________(填“合理”或“不合理”)的,原因是___
(3)丙同学在甲同学的实验结束后,取出C处的棉花,将其与另一个沾有淀粉KI溶液的棉花(E)接触,发现E慢慢出现蓝色,结合甲的实验现象,他认为可以确定同主族元素非金属性的递变规律,你同意此种观点吗?______(填“同意”或“不同意”),理由是__________
(4)丁同学综合分析了前面几位同学的实验,认为若将沾有Na2S溶液的棉花置于玻璃管中适当的位置,此实验还可以同时探究同周期元素性质的递变规律,他提出此观点的依据是___,预期的现象与结论是___________,相应反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“笔、墨、纸、砚”在中国传统文化中被称为“文房四宝”,下列说法中错误的是( )
A.羊毫笔笔头用山羊毛制成,用灼烧法可鉴别羊毫和化纤
B.“松烟墨”以松树烧取的烟灰制成,用此墨写字日久会褪色
C.制作宣纸的原料有青檀树皮和稻草,其主要成分均是纤维素
D.端砚石主要成分含水白云母![]() ,它属于硅酸盐
,它属于硅酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下,则下列判断正确的是( )
![]()
A.MFe2Ox是氧化剂
B.SO2是该反应的催化剂
C.x<y
D.MFe2Oy是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将3molSO2和1 molO2充入一定容密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+ O2(g)![]() 2SO3(g) △H=-197kJ/ mol,当达到平衡状态时,下列说法中正确的是
2SO3(g) △H=-197kJ/ mol,当达到平衡状态时,下列说法中正确的是
A.SO2与O2的转化率可能相等
B.容器中一定存在n(SO2)>1mol且n(SO3)<2mol
C.放出的热量为197kJ
D.当O2的转化率为50%时SO2和SO3 的物质的量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出符合下列要求的离子方程式:
(1)等体积、等物质的量浓度的碳酸氢钙溶液与氢氧化钠溶液混合_________________;
(2)等体积、等物质的量浓度的碳酸氢钙溶液与氢氧化钙溶液混合____________________;
(3)等体积、等物质的量浓度的碳酸氢钠溶液与氢氧化钡溶液混合____________________;
(4)氢氧化钙与碳酸氢钠等物质的量在溶液中反应______________________________;
(5)氢氧化钙与碳酸氢钠按物质的量比1∶2在溶液中反应______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1mol·L-1一元酸HR溶液中逐渐通入氨气[已知常温下NH3·H2O电离平衡常数K=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
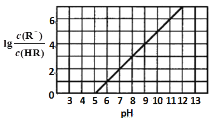
A.0.1mol·L-1HR溶液的pH为5
B.当pH=6时,水电离出的氢离子浓度为1.0×10-6
C.当通入0.1 mol NH3时,c(![]() )>c(R-)>c(H+)>c(OH-)
)>c(R-)>c(H+)>c(OH-)
D.当 pH=7时,c(![]() )=c(R-)
)=c(R-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g) + 5O2(g) == 3CO2(g) +4H2O(l) ΔH=-a kJ·mol-1
途径II:C3H8(g) ==C3H6(g)+ H2(g) ΔH=+b kJ·mol-1
2C3H6(g)+ 9O2(g) == 6CO2(g) +6H2O(l) ΔH=-c kJ·mol-1
2H2(g)+O2(g) == 2H2O(l) ΔH=-d kJ·mol-1(a、b、c、d均为正值)
请回答下列问题:
(1)判断等量的丙烷通过两种途径放出的热量,途径I放出的热量 ______(填“大于”、“等于”或“小于”)途径II放出的热量。
(2)由于C3H8(g) ==C3H6(g)+ H2(g) 的反应中,反应物具有的总能量______(填“大于”、“等于”或“小于”)生成物具有的总能量,那么在化学反应时。反应物就需要______(填“放出”、或“吸收”)能量才能转化为生成物,因此其反应条件是______________。
(3)b 与a、c、d的数学关系式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积固定的密闭容器中,加入2molA和1molB发生下列反应并且达到化学平衡状态,2A(g)+B(g) ![]() 3C(g)+D(g),平衡时C的浓度为amol·L-1。若维持容器体积和温度不变,按下列4种方法配比作为起始物质充入该容器中,达到平衡后,C的浓度仍为amol·L-1的是( )
3C(g)+D(g),平衡时C的浓度为amol·L-1。若维持容器体积和温度不变,按下列4种方法配比作为起始物质充入该容器中,达到平衡后,C的浓度仍为amol·L-1的是( )
A.4molA+2molB B.3molC+1molB+1molD+1molA
C.2molA+1molB+1molD D.1molA+0.5molB + 1.5molC+0.5molD
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com