
分析 根据M=$\frac{m}{n}$可计算出混合气体的平均摩尔质量;设出一氧化碳和二氧化碳的物质的量,然后根据总质量、总体积列式计算出二氧化碳的物质的量即可.
解答 解:标准状况下17.92L混合气体的物质的量为:$\frac{17.92L}{22.4L/mol}$=0.8mol,该混合气体的平均摩尔质量为:$\frac{25.6g}{0.8mol}$=32g/mol,则此混合气体的平均分子质量为32;
设该混合气体中含有CO和CO2的物质的量分别为x、y,
则:28x+44y=25.6、x+y=0.8,
解得:x=0.6mol、y=0.2mol,
故答案为:32;0.2 mol.
点评 本题考查了物质的量的计算,题目难度不大,明确平均分子质量与平均摩尔质量的关系为解答关键,注意掌握物质的量与摩尔质量、气体摩尔体积之间的关系,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
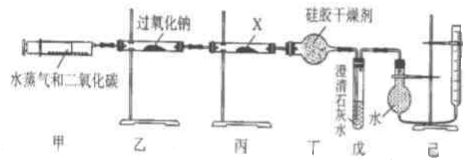
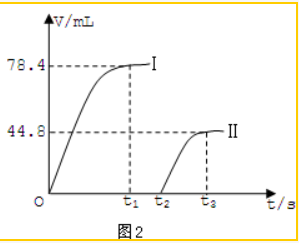
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、NaCl、AgNO3 | B. | Na2SO4、NaOH、HCl | ||
| C. | Na2SO4、NaNO3、NaOH | D. | Na2SO4、BaCl2、CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH 3CH 2CH2 CHO醛类 | B. | 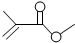 饱和酯类 饱和酯类 | ||
| C. | 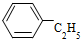 芳香烃 芳香烃 | D. | CH 3CH 2 COOH 羧酸类 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 人体内的铁是以Fe2+ 和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.
人体内的铁是以Fe2+ 和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能说明NH3结合H+能力比H2O强:NH3+H3O+=NH4++H2O | |
| B. | 能说明氧化性H2O2>Fe3+:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| C. | 能说明盐酸是强酸:HCl+AgNO3=AgCl↓+HNO3 | |
| D. | 能说明CH3COOH是弱电解质:CH3COO-+H2O?CH3COOH+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 序号 | 碳酸钙 状态 | c(HCl) /mol•L-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 粒状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 粒状 | 0.6 | 20 | 41 | 280 |
| 4 | 粒状 | 0.8 | 20 | 40 | 200 |
| 5 | 粉末 | 0.8 | 20 | 40 | 30 |
| 6 | 粒状 | 1.0 | 20 | 40 | 120 |
| 7 | 粒状 | 1.0 | 30 | 50 | 40 |
| 8 | 粒状 | 1.2 | 20 | 40 | 90 |
| 9 | 粒状 | 1.2 | 25 | 45 | 40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com