
(16分) 科学家发现在特殊条件下,水能表现出许多有趣的结构和性质。
(1)一定条件下给水施加一个弱电场,常温常压下水结成冰,俗称“热冰”,其计算机模拟图如下。
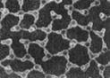



水 热冰
采用“弱电场”的条件使水结成“热冰”,说明水分子是________分子(填“极性”或“非极性”)。请你展开想象,给“热冰”设计一个应用实例____________。
(2)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子。
① 释放出来的电子可以被若干水分子形成的“网”捕获而形成水合电子,你认为水分子间能形成“网”的原因是___________________。
② 由水分子释放出电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式___ ________;该阳离子还能与水分子作用生成羟基,经测定此时的水具有酸性,写出该过程的离子方程式_______。
(3)写出元素组成与水相同的物质W的电子式 , 写出W与FeCl2在酸性溶液中反应的离子方程式 。
(4)水溶液中存在H3O+ 离子,写出该微粒的结构式 (标出配位键)。
(1)极性;建造室温溜冰场;
(2)①水分子间存在氢键;
②2H2O++SO2=H++SO42-;H2O++H2O=H3O++—OH
(3)
2Fe2+ + H2O2 + 2H+= 2Fe3+ +2H2O
(4)
【解析】
试题分析:(1)在电场作用下的凝结,说明分子是极性分子;常温常压下的固态水应用广泛,如:建造室温溜冰场,制造热冰淇淋等。
(2)①水分子之间形成氢键,使水分子联系成网。
②由水分子释放出电子时产生的一种阳离子可以表示成H2O+,由于氧化性很强氧化SO2生成硫酸,2H2O++SO2=4H++SO42-,根据信息和电荷守恒,H2O++H2O=H3O++—OH
(3)元素组成与水相同的物质W为H2O2,电子式为: ;H2O2具有氧化性,在酸性条件下把Fe2+氧化为Fe3+,离子方程式为:2Fe2+ +H2O2 +2H+= 2Fe3+ +2H2O
;H2O2具有氧化性,在酸性条件下把Fe2+氧化为Fe3+,离子方程式为:2Fe2+ +H2O2 +2H+= 2Fe3+ +2H2O
(4)H3O+ 离子中含有两个H—O键和一个配位键,所以结构式为:
考点:本题考查极性分子和非极性分子、氢键、化学键与晶体结构、电子式与结构式。


科目:高中化学 来源:2015届江苏省淮安市协作体高二下学期期中考试化学试卷(解析版) 题型:选择题
下列关于铜电极的叙述不正确的是
A、铜锌原电池中铜是正极
B、用电解法精炼铜时粗铜作阳极
C、在镀件上镀铜时可用铜作阳极
D、电解稀H2SO4制H2、O2时铜做阳极
查看答案和解析>>
科目:高中化学 来源:2015届江苏省无锡江阴市高二下学期期中考试化学试卷(解析版) 题型:选择题
SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:1molS(s)转化为气态硫原子吸收能量280kJ,断裂1molF-F 、S-F键需吸收的能量分别为160kJ、330kJ。则S(s)+3F2(g)=SF6(g)的反应热△H为
A.-1780kJ/mol B.-1220 kJ/mol C.-450 kJ/mol D.+430 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高二下学期4月阶段测试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.水电离出的c(H+)=10-12mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
C.c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高二下学期4月阶段测试化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是

A.图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图Ⅱ表示表示向KAl(SO4)2溶液中滴加Ba(OH)2溶液产生沉淀的物质的量(n)随氢Ba(OH)2溶液体积(V)的变化
C.图Ⅲ表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液
D.图Ⅳ表示某可逆反应生成物的物质的量随反应时间变化的曲线,t时刻反应正速率最大
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期摸底考试化学试卷(解析版) 题型:填空题
(12 分) 为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。

请回答:
(1)写出步骤Ⅰ反应的离子方程式: 。
(2)试剂X是 。步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是 。
(3)进行步骤Ⅱ时,该小组用如图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 。

(4)用固体F制备CuSO4溶液,可设计以下三种途径:

写出途径①中反应的离子方程式 , 请选出你认为的最佳途径并说明选择的理由 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期摸底考试化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如
图所示。下列说法不正确的是

A.离子半径的大小顺序为:r(W2—)>r(Q—)>r(Y2—)>r(Z3+)
B.元素W的最高价氧化物对应水化物的酸性比Q的强
C.元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D.X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应
查看答案和解析>>
科目:高中化学 来源:2015届江苏省南京市高三9月学情调研卷化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 用铂丝蘸取少量某无色溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
B | 向浓度均为0.1 mol·L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
C | 向溶液X中滴加稀盐酸 | 有气体产生 | 溶液X 中一定含有CO32- |
D | 向含H2SO4的淀粉水解液中加入新制的Cu(OH)2,煮沸 | 没有砖红色沉淀 | 淀粉未水解 |
查看答案和解析>>
科目:高中化学 来源:2015届广东肇庆中学高三8月考理综化学试卷(解析版) 题型:选择题
下列陈述I、II正确并且有因果关系的是
选项 | 陈述I | 陈述II |
A | SO2和氯水有漂白性 | 两者都能使溴水褪色 |
B | 用淀粉-KI鉴别FeCl2 | Fe2+有氧化性 |
C | 盐酸和氨水能溶解Al(OH)3 | Al(OH)3是两性氢氧化物 |
D | CuSO4可以用作游泳池消毒剂 | 铜盐能使蛋白质变性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com