
| A. | 0.15 mol•L-1 | B. | 0.225 mol•L-1 | C. | 0.30 mol•L-1 | D. | 0.45 mol•L-1 |
分析 发生3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,n(H+)=0.3mol/L×0.1L+0.15mol/L×2×0.1L=0.06mol,n(NO3-)=0.3mol/L×0.1L=0.03mol,n(Cu)=$\frac{2.56g}{64g/mol}$=0.04mol,结合过量判断及c=$\frac{n}{V}$计算.
解答 解:n(H+)=0.06mol,n(NO3-)=0.03mol,n(Cu)=0.04mol,
由3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3 8 2
则0.04molCu完全反应,需要氢离子为$\frac{0.04mol×8}{3}$>0.06mol,需要硝酸根离子为$\frac{0.04mol×2}{3}$<0.03mol,
则氢离子不足,氢离子完全反应,
n(Cu2+)=$\frac{0.06mol×3}{8}$=0.025mol,
所得溶液中铜离子的物质的量浓度是$\frac{0.025mol}{0.1L}$=0.225mol/L,
故选B.
点评 本题考查氧化还原反应的计算,为高考常见题型和高频考点,把握发生的反应、过量判断为解答的关键,侧重分析与计算能力的考查,注意氢离子不足完全反应,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 原子半径:A<B<C | |
| B. | A的氢化物的稳定性大于C的氢化物的稳定性 | |
| C. | A的最高价氧化物与B的单质可以发生置换反应 | |
| D. | C的氧化物的熔点比A的氧化物熔点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的沸点高于HCl | B. | 金刚石的熔点比晶体硅高 | ||
| C. | 稀有气体一般很难发生化学反应 | D. | 常温下单质溴呈液态、碘呈固态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0kJ/mol | |
| C. | 铁粉与硫粉需要加热才能发生的反应,则此反应是吸热反应 | |
| D. | 1mol甲烷燃烧生成水和二氧化碳所放出的热量就是甲烷燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
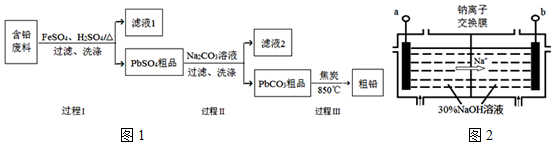
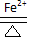 2PbSO4+2H2O.
2PbSO4+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com