
【题目】下列分子的空间构型可用sp2杂化轨道来解释的是( )
①BF3 ②CH2=CH2 ③![]() ④CH≡CH ⑤NH3 ⑥CH4
④CH≡CH ⑤NH3 ⑥CH4
A. ①②③B. ①②④C. ③④⑤D. ①②③④
科目:高中化学 来源: 题型:
【题目】将1 mol乙醇(其中的氧用18O标记)在浓硫酸存在条件下与足量乙酸充分反应。下列叙述错误的是( )
A. 生成的乙酸乙酯中含有18O
B. 生成的水分子中不含有18O
C. 可能生成88 g乙酸乙酯
D. 可能生成90 g乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲、乙、丙、丁四种有机物说法正确的是
A.  与 NaOH的水溶液共热,反应后生成的醇能被氧化为醛
与 NaOH的水溶液共热,反应后生成的醇能被氧化为醛
B. CH3Cl中加入NaOH的水溶液共热,再滴入AgNO3溶液,可检验该物质中含有的卤素原子
C. 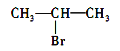 发生消去反应得到两种烯烃
发生消去反应得到两种烯烃
D. CH3Cl、 、
、 中加入 NaOH的醇溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,均有沉淀生成
中加入 NaOH的醇溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,均有沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表为某有机物与各种试剂的反应现象,则这种有机物可能是
试剂 | 钠 | 溴水 | NaHCO3溶液 |
现象 | 放出气体 | 褪色 | 放出气体 |
A. CH2═CH﹣CH2﹣OHB. ![]()
C. CH2═CH﹣COOHD. CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备溴乙烷的装置(已知溴乙烷的沸点38.4℃)。步骤如下:
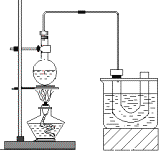
①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇(密度为0.789g/cm3)、28mL78%浓硫酸,然后加入研细的23g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应。
已知:NaBr+H2SO4=HBr+NaHSO4
请回答下列问题:
(1)写出烧瓶中制备溴乙烷的化学方程式___________________________________。
(2)在大烧杯加入冰水的作用是____________________________________。溴乙烷的水溶性小于乙醇的水溶性,其原因是_________________________。反应一段时间后,U型管内可观察到的现象是___________________________。
(3)反应时若温度过高会有副反应发生,写出发生有机副反应的化学方程式________。(任写一个)
(4)反应结束后,U形管中粗制的溴乙烷呈棕黄色。为了除去粗产品中的杂质,最好选择下列试剂中的__________(填序号)
A.H2O B.CCl4 C.Na2SO3溶液 D.NaOH溶液
除杂所需的主要玻璃仪器是__________________(填仪器名称)。要进一步制得纯净的溴乙烷,可再用水洗,然后加入无水CaCl2,再进行_________________(填操作名称)。
(5)最后制得溴乙烷产品14.2g,求上述实验中溴乙烷的产率为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温常压下,等质量的CH4和A气体的体积之比为15:8,则A的摩尔质量为________。
(2)已知标准状况下,H2和O2的混合气体体积为11.2L,混合后总质量为13克,则混合气体的平均摩尔质量为_________,其中混有氧气的体积为__________。
(3)已知某种植物营养液配方如下:0.6mol KCl,0.4molK2SO4 ,0.2mol ZnSO4和1L水,若以KCl、K2SO4、ZnCl2和水来配制,则需KCl______mol,K2SO4___________mol,ZnCl2_____________mol。
(4)某固体物质A在一定条件下受热分解产物都是气体,有关化学方程式为:2A=B↑+2C↑+2D↑。若生成的混合气体对氢气的相对密度为d,则A的相对分子质量为_______(用d表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CH4与Cl2发生取代反应制取副产品盐酸的设想在工业上已成为现实,某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如图所示。根据要求填空:
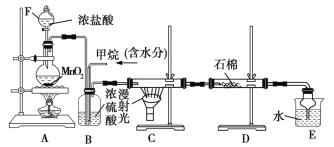
(1)实验室制取Cl2的化学反应方程式为__________。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的HCl,则x的取值范围为____。
(3)B装置有三种功能:①控制气体流速;②将气体混合均匀;③___________。
(4)D装置中的石棉上吸附着KI饱和溶液及KI粉末,其作用是___________________。
(5)E装置的作用是____(填字母,双选)。
A.收集气体 B.吸收Cl2
C.防止倒吸 D.吸收HCl
(6)E装置制得的盐酸中还含有有机物,将两者分离的最佳方法为________。
(7)该装置还存在缺陷,原因是没有进行尾气处理,尾气的主要成分是____(填字母,双选)。
A.CH4 B.CH3Cl C.CH2Cl2 D.CHCl3 E.CCl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。

①A中发生反应离子方程式为_____________________。
②将仪器连接好以后,必须进行的第一步操作是_____________________。
③B装置出来的气体是否需要干燥_________________。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式_____________,______________。
⑤D中NaOH溶液的作用_______________________。
⑥实验结束时,读取实验中生成气体的体积时,不合理的是_______________。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为__________________。
⑧实验完成后E到F之间导管内残留水的体积会使测量结果__________。(填“偏大”、“偏小”或“不影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ca(ClO)2与浓盐酸反应会生成Cl2,该反应的化学方程式为Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O
(1)浓盐酸在反应中显示出来的性质是_____(填写字母)。
A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)产生0.3 mol Cl2,则转移的电子的物质的量为______mol。
(3)用双线桥法表示该氧化还原反应中电子转移的方向和数目_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com