
| A. | C5H12属于烷烃且有三种同分异构体 | |
| B. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯是发生取代反应 | |
| C. | 淀粉和纤维素均可用(C6H10O5)n表示,因此它们互为同分异构体 | |
| D. | 乙酸、葡萄糖在一定条件下均能与Cu(OH)2反应 |
分析 A、戊烷有三种同分异构体;
B、依据取代反应定义判断即可;
C、淀粉和纤维素分子式中聚合度不同,分子式不同;
D、乙酸具有酸性,和氢氧化铜发生中和反应,葡萄糖含醛基,能被弱氧化剂氧化.
解答 解:A、烷烃的通式为CnH2n+2,故C5H10不属于烷烃,C5H12符合烷烃的通式,且有正戊烷、异戊烷和新戊烷三种同分异构,故A正确;
B、苯与浓硝酸、浓硫酸混合共热时,硝基取代了苯环上的氢形成硝基苯,属于取代反应,故B正确;
C、淀粉和纤维素分子式中聚合度不同,分子式不同,故二者不是同分异构体,故C错误;
D、乙酸具有酸性,和氢氧化铜发生中和反应,葡萄糖含醛基,能被氢氧化铜氧化,故D正确;
故选C.
点评 本题考查了常见有机物的性质,中等难度.注意淀粉和纤维素虽可用(C6H10O5)n表示,但二者由于聚合度不同,二者不是同分异构体.


科目:高中化学 来源: 题型:解答题
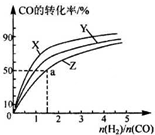 天然气、可燃冰的主要成分都是甲烷,甲烷既是一种清洁能源,又是一种重要的化工原料.
天然气、可燃冰的主要成分都是甲烷,甲烷既是一种清洁能源,又是一种重要的化工原料.| 温度(℃) | 800 | 1000 | 1200 | 1400 |
| 平衡常数(K) | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液中离子浓度的关系满足:c(H+)═c(OH-)+c(CH3COO-) | |
| B. | 用0.100 0 mol•L-1NaOH滴定未知浓度的CH3COOH溶液,恰好反应时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| D. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(CH3COOH)═c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- | |
| B. | 将氯气通入冷的氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O | |
| C. | 铝片与氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑ | |
| D. | NaHCO3溶液中加入盐酸:CO32-+2H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①③⑥ | C. | ①③④ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、Na+、NO3-、Cl- | B. | H+、Mg2+、SO42-、ClO- | ||
| C. | Cu2+、Mg2+、SO42-、NO3- | D. | NH4+、Ba2+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com