
分析 (1)根据已知量求出反应热,再根据热化学方程式的书写原则解答;
(2)化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算分别吸收和放出的能量,以此计算反应热并判断吸热还是放热.
解答 解:(1)适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量,所以每生成92克NO2需要吸收的热量为:$\frac{92g}{23g}$×16.95kJ=67.8kJ,
则该反应的热化学方程式为:N2(g)+2O2(g)=2NO2(g)△H=+67.8kJ•mol-1,
故答案为:N2(g)+2O2(g)=2NO2(g)△H=+67.8kJ•mol-1;
(2)在反应N2+3H2?2NH3中,断裂3molH-H键、1molN三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,生成2molNH3时共形成6molN-H键,放出的能量为:6×391kJ=2346kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量=2346kJ-2254kJ=92kJ,
则N2与H2反应生成NH3的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92kJ•mol-1.
点评 本题考查了热化学方程式的书写,题目难度中等,明确热化学方程式的书写原则为解答关键,注意掌握反应热与化学键键能之间的关系,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:实验题
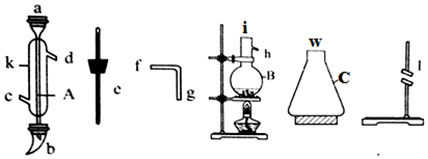
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1 mol CO2、CO的混合气中含有的氧原子数为1.5NA | |
| B. | 标准状况下,11.2LCCl4所含的分子数为0.5 NA | |
| C. | 25℃,1.01×105Pa,66gCO2中所含原子数为4.5NA | |
| D. | 1 mol•L-1 CuCl2溶液中含有的氯离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
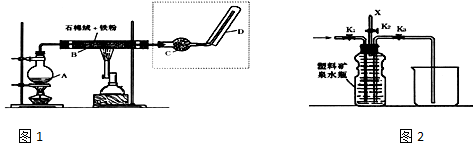
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图1表示:
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用图1表示:
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
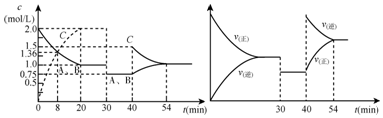
| A. | 30min时降低温度,40min时升高温度 | |
| B. | 8min前A的平均反应速率为0.16mol/(L•min) | |
| C. | 反应方程式中的x=1,正反应为吸热反应 | |
| D. | 20min~40min间该反应的平衡常数均为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷与氯气的混合气体在光照下反应,生成的是一氯甲烷与氯化氢 | |
| B. | 向盛有乙醇的烧杯中投入一小块金属钠,可以观察到钠块沉在乙醇液面下面 | |
| C. | 氯仿能发生水解反应和消去反应 | |
| D. | 乙烯可作水果催熟剂,无水乙醇直接用作医疗消毒剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com