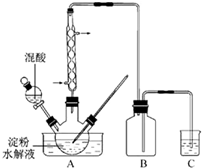
(2011?江苏)草酸是一种重要的化工产品.实验室用硝酸氧化淀粉水解液制备草酸的装置如图14所示(加热、搅拌和仪器固定装置均已略去)
实验过程如下:
①将一定量的淀粉水解液加入三颈瓶中
②控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO
3与98%H
2SO
4的质量比为2:1.5)溶液
③反应3h左右,冷却,抽滤后再重结晶得草酸晶体.
硝酸氧化淀粉水解液过程中可发生下列反应:
C
6H
12O
6+12HNO
3→3H
2C
2O
4+9NO
2↑+3NO↑+9H
2O
C
6H
12O
6+8HNO
3→6CO
2+8NO↑+10H
2O
3H
2C
2O
4+2HNO
3→6CO
2+2NO↑+4H
2O
(1)检验淀粉是否水解完全所需用的试剂为
碘水
碘水
.
(2)实验中若混酸滴加过快,将导致草酸产率下降,其原因是
由于温度过高、硝酸浓度过大,导致C6H12O6和H2C2O4进一步被氧化
由于温度过高、硝酸浓度过大,导致C6H12O6和H2C2O4进一步被氧化
.
(3)装置C用于尾气吸收,当尾气中n(NO
2):n(NO)=1:1时,过量的NaOH溶液能将NO,全部吸收,原因是
NO2+NO+2NaOH=2NaNO2+H2O
NO2+NO+2NaOH=2NaNO2+H2O
(用化学方程式表示)
(4)与用NaOH溶液吸收尾气相比较,若用淀粉水解液吸收尾气,其优、缺点是
优点:提高HNO3利用率
缺点:NOx吸收不完全
优点:提高HNO3利用率
缺点:NOx吸收不完全
.
(5)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有
布氏漏斗、吸滤瓶
布氏漏斗、吸滤瓶
.

 (2011?江苏)草酸是一种重要的化工产品.实验室用硝酸氧化淀粉水解液制备草酸的装置如图14所示(加热、搅拌和仪器固定装置均已略去)
(2011?江苏)草酸是一种重要的化工产品.实验室用硝酸氧化淀粉水解液制备草酸的装置如图14所示(加热、搅拌和仪器固定装置均已略去)

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案


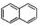 )的衍生物,且取代基都在同一个苯环上;③可发生水解反应,其中一种水解产物能发生银镜反应,另一种水解产物分子中有5种不同化学环境的氧.
)的衍生物,且取代基都在同一个苯环上;③可发生水解反应,其中一种水解产物能发生银镜反应,另一种水解产物分子中有5种不同化学环境的氧.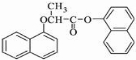

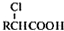 ,写出以苯酚和乙醇为原料制备
,写出以苯酚和乙醇为原料制备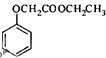 的合成路线流程图
的合成路线流程图
