

分析 (1)溴易挥发,热空气可使溴蒸气进入B中;
(2)步骤③中,向B中通入足量SO2,与溴发生氧化还原反应生成硫酸、HBr;
(3)尾气含SO2、Br2,均与碱溶液反应;
(4)C中反应生成了NaBrO3,可知Br元素的化合价升高,则还应生成NaBr;
(5)C比B更容易操作,尾气处理效果好.
解答 解:(1)步骤②中鼓入热空气的作用为使A中生成的Br2 随空气流进入B中,
故答案为:使A中生成的Br2 随空气流进入B中;
(2)步骤③中发生的主要反应的离子方程式为Br2+SO2+2H2O=4H++2Br-+SO42-,
故答案为:Br2+SO2+2H2O=4H++2Br-+SO42-;
(3)尾气含SO2、Br2,均与碱溶液反应,则选NaOH溶液吸收尾气,故答案为:C;
(4)C中反应生成了NaBrO3,可知Br元素的化合价升高,则还应生成NaBr,且酸与碳酸钠反应生成二氧化碳,该反应为3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑,
故答案为:3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑;
(5)与B装置相比,采用C装置的优点为C装置的优点为操作简单、污染小,
故答案为:操作简单、污染小.
点评 本题考查物质的制备实验及海水资源应用,为高频考点,把握物质的性质、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意实验装置的作用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 17 | B. | 25 | C. | 27 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
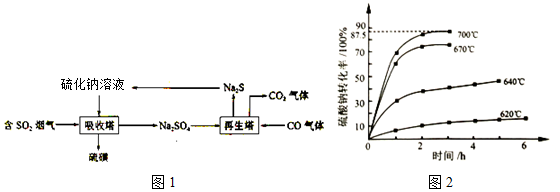
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥⑦ | B. | ②④⑥ | C. | ③②⑤⑧ | D. | ①④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(NO2)/mol•L-1 | 0.10 | 0.20 | 0.20 |
| C(SO2)/mol•L-1 | 0.10 | 0.10 | 0.20 |
| A. | 容器甲中的反应在前2 min的平均速率v(SO2)=0.05 mol•L-1•min-1 | |
| B. | 达到平衡时,容器丙中正反应速率与容器甲相等 | |
| C. | 温度升至90℃,上述反应平衡常数为1.56,则反应的△H>0 | |
| D. | 容器乙中若起始时改充0.10 mol•L-1 NO2和0.20mol•L-1 SO2,达到平衡时c(NO)与原平衡相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ①③ | C. | ②③ | D. | ① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com