
| A.热稳定性:CH4>SiH4>HF | B.原子半径:Na>Mg>O |
| C.酸性:HClO4>H2SO4>H3PO4 | D.非金属性:F>Cl>Br |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.该元素属于第六周期 |
| B.该元素位于第ⅢA族 |
| C.该元素为金属元素,性质与82Pb相似 |
| D.该同位素原子含有114个电子,185个中子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

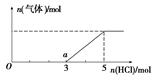
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铍(Be)的氧化物的水化物可能具有两性 |
| B.砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于酸 |
| C.硫酸锶(SrSO4)是难溶于水的白色固体 |
| D.硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
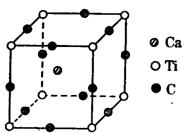
科目:高中化学 来源:不详 题型:填空题
 ”或“
”或“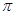 ”)。
”)。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:N>O>F |
| B.酸性强弱:HNO3>H3PO4>H2SO4 |
| C.碱性强弱:KOH >NaOH>Mg(OH)2 |
| D.氢化物的稳定性:HF>HCl>H2S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com