
已知如果反应物的总能量大于生成物的总能量,那么该反应为放热反应,反之为吸热反应。
请你列举出三个放热反应的例子,用离子方程式表示:
①_________________________________
②_________________________________
③_________________________________
再列举出三个吸热反应的例子,用化学方程式表示:
①_________________________________
②_________________________________
③_________________________________
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
将化学知识的系统化,有助于对化学问题的进一步认识。请你参与下列关于化学反应的讨论。
问题1:从不同的角度,化学反应可以有不同的分类方法。四种基本反应类型是从物质的组成和性质进行的分类,氧化还原反应和离子反应则是从其他不同的角度进行分类的。请在上图的方框中,用图示的方法表示离子反应、化合反应和氧化还原反应之间的关系。
问题2:不同化学反应进行的快慢和程度千差万别。反应的快慢和程度是化工生产考虑的两个重要因素。请你按照表中要求完成下表(填写内容不能重复)。
| 序号 | 实际生产中采取的措施 | 工业生产实例(写名称) |
| (1) | 通过增大压强提高原料转化率 | |
| (2) | 使用催化剂增大反应的速率 |
问题3:化学反应中均伴随着能量的变化。如果一个化学反应中,反应物的总能量和生成物
的总能量有如图所示的关系,则该反应过程中的能量变化是 。
 已知热化学方程式为:
已知热化学方程式为:
C(g) + O2(g)= CO2 (g) △H= ―393.5KJ/mol
H2 (g) + 1/2O2 (g)= H2O (l) △H= ―285.8KJ/mol
试通过计算说明等质量的氢气和碳燃烧时产生热量的比是 (保留1位小数)。
问题4:化学反应的发生是有条件的。反应物相同,反应的条件不同,反应的原理不同。
如:4Na+O2=2Na2O 2Na+O2![]() Na2O2 ;事实上还有许多条件可以影响化学反应的发生,请用离子反应方程式表示下列观点:反应物相同,反应物的浓度不同,反应的原理不同: 。
Na2O2 ;事实上还有许多条件可以影响化学反应的发生,请用离子反应方程式表示下列观点:反应物相同,反应物的浓度不同,反应的原理不同: 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(08浙江舟山中学月考) 将化学知识的系统化,有助于对化学问题的进一步认识。请你参与。
问题1:从不同的角度,化学反应可以有不同的分类方法。四种基本反应类型是从物质的组成和性质进行的分类,氧化还原反应和离子反应则是从其他不同的角度进行分类的。请在右图的方框中,用图示的方法表示离子反应、化合反应和氧化还原反应之间的关系(用一个圆圈表示一类反应)。
问题2:不同化学反应进行的快慢和程度千差万别。反应的快慢和程度是化工生产考虑的两个重要因素。请你按照表中要求完成下表(填写内容不能重复)。
序号 | 实际生产中采取的措施 | 工业生产实例(写名称) |
(1) | 通过增大压强提高原料转化率 |
|
(2) | 使用催化剂增大反应的速率 |
|
问题3:化学反应中均伴随着能量的变化。如果一个化学反应中,反应物的总能量和生成物的总能量有如图所示的关系,则该反应过程中的能量变化是 (填放热或吸热)。

已知热化学方程式为:
C(s) + O2(g)= CO2 (g) △H= ―393.5KJ?mol-1
H2 (g) + 1/2O2 (g)= H2O (l) △H= ―285.8KJ?mol-1
试通过计算说明等质量的氢气和碳燃烧时产生热量的比是 :1(保留1位小数)。
问题4:化学反应的发生是有条件的。反应物相同,反应的条件不同,反应的原理不同。如:
4Na+O2=2Na2O 2Na+O2![]() Na2O2 ;事实上还有许多条件可以影响化学反应的发生,请用化学反应方程式表示下列观点:反应物相同,反应物的浓度不同,反应的原理不同:
Na2O2 ;事实上还有许多条件可以影响化学反应的发生,请用化学反应方程式表示下列观点:反应物相同,反应物的浓度不同,反应的原理不同:
查看答案和解析>>
科目:高中化学 来源: 题型:
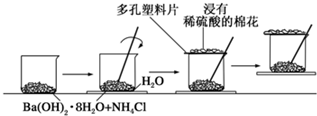
(1)某同学设计了如下实验流程:在一个小烧杯里,加入20g Ba(OH)2·8H2O晶体和10gNH4Cl晶体,
然后将小烧杯放在事先已滴有3滴~4滴水的玻璃片上,并立即用玻璃棒迅速搅拌。实验流程示意图
如下,回答下列问题:

①实验中玻璃棒的作用是 ▲ 。
②浸有稀硫酸的棉花的作用是 ▲ 。
③通过 ▲ 现象,说明该反应为 ▲ (填“吸热”或“放热”)反应,这是由于反应物的
总能量 ▲ (填“小于”、 “大于” 或“等于”)生成物的总能量。
(2)沼气是一种廉价能源,农村存在大量的秸秆、杂草等废弃物,它们经微生物发酵之后,便可产生
沼气,可用来点火做饭。在农村推广建造沼气池,不仅能有效地利用 ▲ 能,还能为农业生产提
供优良的肥料。已知: 标准状况下的112.0L CH4气体完全燃烧,生成CO2和液态水,放出4448kJ
的热量。
①写出CH4完全燃烧的热化学方程式为 ▲ 。
②如果上述反应生成的是水蒸气,则反应放出的热量 ▲ 4448kJ。(填“>”或“<”或“=”)
(3)钢铁在潮湿的空气中生锈主要是由电化学腐蚀造成的,发生腐蚀时铁和内部的杂质碳及钢铁表
面的电解质溶液形成原电池。钢铁发生电化学腐蚀时铁作为原电池的 ▲ 极,此电极反应式为
▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com