
溶液X中可能含有K+、Mg2+、Al3+、AlO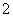 、SiO
、SiO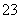 、CO
、CO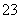 、SO
、SO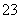 、SO
、SO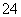 中的若干种离子。某同学对该溶液进行了如下实验:
中的若干种离子。某同学对该溶液进行了如下实验:

下列判断正确的是( )
A.气体甲一定是纯净物
B.沉淀甲是硅酸和硅酸镁的混合物
C.K+、AlO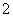 和SiO
和SiO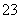 一定存在于溶液X中
一定存在于溶液X中
D.CO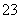 和SO
和SO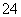 一定不存在于溶液X中
一定不存在于溶液X中
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.Li在氧气中燃烧只生成Li2O[gkstk.Com]
B.将SO2通入过量BaCl2溶液可生成BaSO3沉淀
C.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
D.将稀硫酸滴加到Fe(NO3)2溶液中无明显现象
查看答案和解析>>
科目:高中化学 来源: 题型:
常见离子共存情况剖析
| 常见离子组合 | 共存情况 | 原因 |
| (1)Ba2+、Ca2+与SO | ||
| CO | ||
| (2)Mg2+与SO | ||
| (3)OH-与NH | ||
| (4)OH-与Mg2+、Al3+、Fe2+ | ||
| (5)H+与CH3COO-、ClO-、 | ||
| HCO | ||
| (6)Fe3+、Al3+与CO | ||
| HCO | ||
| (7)NO | ||
| (8)Fe3+与S2-、I- | ||
| (9)MnO | ||
| (10)NH |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式不正确的是( )
A.Cl2与稀NaOH溶液反应:Cl2+2OH-===Cl-+ClO-+H2O
B.Fe2(SO4)3和KI溶液反应:Fe3++2I-===Fe2++I2
C.烧碱溶液中加入铝片:2Al+2OH-+2H2O===2AlO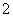 +3H2↑
+3H2↑
D.用浓盐酸与MnO2反应制取少量氯气:MnO2+4H++2Cl-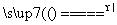 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用粗氧化铜(含杂质FeO)为原料制取氯化铜晶体(CuCl2·2H2O)的生产流程如下:
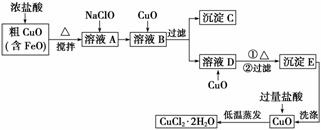
(1)浓盐酸溶解粗CuO时可能发生的离子方程式______________、____________。
(2)写出向溶液A中加入NaClO的离子方程式:__________________________________。
(3)用沉淀C制取FeCO3的流程如下:
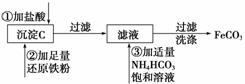
完成上述转化过程中的离子方程式
①________________________________________________________________________;
②________________________________________________________________________;
③________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.反应焓变是指1 mol物质参加反应时的能量变化
B.当反应放热时,ΔH>0,反应吸热时,ΔH<0
C.在加热条件下发生的反应均为吸热反应
D.一个化学反应中,当反应物能量大于反应产物能量时,反应放热,ΔH为“-”
查看答案和解析>>
科目:高中化学 来源: 题型:
在100 kPa和298 K时,有关反应的热化学方程式有:
H2(g)+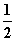 O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
H2(g)+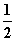 O2(g)===H2O(l) ΔH2=-285.8 kJ·mol-1
O2(g)===H2O(l) ΔH2=-285.8 kJ·mol-1
下列说法错误的是( )
A.H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量
B.O2前面的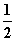 表示参加反应的O2的分子数目
表示参加反应的O2的分子数目
C.1mol物质完全燃烧生成稳定氧化物时放出的热量为燃烧热,H2的燃烧热为285.8 kJ·mol-1
D.1 mol液态水变成水蒸气时吸收44 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下面三个数据:7.2×10-4 mol·L-1、4.6×10-4 mol·L-1、4.9×10-10 mol·L-1分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:
①NaCN+HNO2===HCN+NaNO2,
②NaCN+HF===HCN+NaF,
③NaNO2+HF===HNO2+NaF。
由此可判断下列叙述中,不正确的是( )
A.HF的电离平衡常数为7.2×10-4
B.HNO2的电离平衡常数为4.9×10-10
C.根据①③两个反应即可知三种酸的相对强弱
D.HNO2的电离平衡常数比HCN大,比HF小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.室温下,HClO分子不可能存在于c(OH-)>c(H+)的溶液中
B.室温下,在pH=7的溶液中,CH3COO-不可能大量存在
C.漂白粉只有在酸的存在下生成次氯酸才具有漂白作用
D.c(CH3COO-)=c(Na+)的CH3COOH和CH3COONa的混合溶液呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com