
常温下,下列各组离子在指定溶液中一定能大量共 存的是( )
存的是( )
A.0.1 mol·L-1 NaOH溶液:K+、Na+、AlO2-、CO32-
B.0.1 mol·L-1 Na2CO3溶液:K+、Al3+、NO3-、Cl-
C.pH=3.5的溶液:K+、NH4+、I-、Fe3+
D.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO3-
科目:高中化学 来源: 题型:
下面三种方法都可以制得Cl2:
①MnO2+4HCl(浓)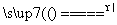 MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
②2KMnO4+16HCl===2KCl+2MnCl2+8H2O+5Cl2↑
③O2+4HCl(气)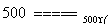 2H2O+2Cl2
2H2O+2Cl2
这三种氧化剂的氧化性由强到弱的顺序是( )
A.O2>MnO2>KMnO4 B.KMnO4>MnO2>O2
C.MnO2>KMnO4>O2 D.O2>KMnO4>MnO2
查看答案和解析>>
科目:高中化学 来源: 题型:
依据氧化还原反应:
2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电
池,如图所示。请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是________溶液。(填名称)
(2)银电极为电池的________极,发生的电极反应为____________________________;X电极上发生的电极反应为____________________________。
(3)外电路中的电子是从________极流向______极(填电极材料)。外电路中每通过0.1 mol电子,银电极的质量理论上增加 g。
(4)原电池工作时,盐桥(装有琼脂-KCl的U型管)里的Cl-移向 电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关沉淀溶解平衡的说法正确的是( )
A.Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度
B.在AgCl的沉淀溶解平衡体系中,加入蒸馏水,AgCl的Ksp增大
C .在AgI的沉淀溶解平衡体系中,加入K2S固体,AgI沉淀可转化为Ag2S沉淀
.在AgI的沉淀溶解平衡体系中,加入K2S固体,AgI沉淀可转化为Ag2S沉淀
D.在CaCO3的沉淀溶解平衡体系中,通入CO2气体,溶解平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于叙述正确的是( )
A.室温下,浓度均为0.05mol/L的NaOH溶液和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12
B.室温下,将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,2c(SO42-)>c(NH4+)
C.室温下,0.1mol/L的盐酸和0.1mol/L的氢氧化钡等体积混合,混合后溶液pH=7
D.室温下,pH=4的醋酸溶液和pH=10的氢氧化钠溶液等体积混合后的溶液pH>7
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是: 。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
 B.2H2(g)+O2(g)=2H2O(1) △H<0
B.2H2(g)+O2(g)=2H2O(1) △H<0
C. NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
(2)以H2SO4溶液为电解质溶液,依据所选反应设计一个原电池,
其正极的电极反应式为
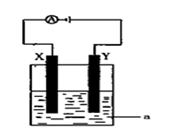
(3)现将你设计的原电池通过导线与下图中电解池相连,其中a为
电解液,X和Y均为惰性电极,则:
①若a为CuSO4溶液,则电解时的化学反应方程式为 。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体为672 mL(标准状况下)时,溶液的pH = (假设电解后溶液体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
若NA表示阿佛加德罗常数,下列说法错误的是
A.一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数一定为0.1NA
B.标准状况下1 mol Cl2反应得到的电子数一定为2NA
C.常温下,2.7g铝与足量的氢氧化钠溶液反应,失去的电子数一定为0.3NA
D.在20℃,101kPa时,4.6gNO2、N2O4的混合气体一定含0.2NA个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
A.含有NA个氧原子的氧气在标准状况下的体积约为22.4 L
B.2 L 0.3 mol·L-1的硫酸钾溶液中钾离子浓度为1.2 mol·L-1
C.常温常压下,32 g O2和O3的混合气体所含原子数为2NA
D.25℃,1.01×105Pa,64 g SO2中含有的原子数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com