
【题目】工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应。现将2 mol SO2 、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%。下列热化学方程式正确的是
A.2SO3(g)![]() 2SO2(g)+O2(g);△H =+196.6 kJ/mol
2SO2(g)+O2(g);△H =+196.6 kJ/mol
B.2SO2(g)+O2(g)![]() SO3(g);△H =-98.3 kJ/mol
SO3(g);△H =-98.3 kJ/mol
C.SO2(g)+1/2O2(g)![]() SO3(g);△H=+98.3 kJ/mol
SO3(g);△H=+98.3 kJ/mol
D.SO2(g)+1/2O2(g)![]() SO3(g);△H=-196.6 kJ/mol
SO3(g);△H=-196.6 kJ/mol
【答案】A
【解析】
试题分析:将2mol SO2、1mol O2充入一密闭容器中充分反应后,放出热量98.3kJ,此时测得SO2的物质的量为1mol,说明反应是可逆反应,不能进行彻底,实际发生反应的二氧化硫为1mol,1mol二氧化硫全部反应放热98.3KJ,热化学方程式为:2SO2(g) + O2(g) 2SO3(g) △H = -196.6 kJmol-1或SO2(g) + 1/2O2(g) SO3(g) △H = -98.3 kJmol-1;A.选项中的热化学方程式符合题意,故A正确;B.选项中的热化学方程式中反应热和对应二氧化硫的量不符合,故B错误;C.反应是放热反应,故C错误;D.反应是放热反应,故D错误;故选A。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源: 题型:
【题目】为制取硝酸铜,某同学设计了如下四种方法:①铜与浓硝酸反应制取硝酸铜;②铜与稀硝酸反应制取硝酸铜;③铜先与空气反应制取氧化铜,再与硝酸反应制取硝酸铜;④铜与硝酸银溶液反应制取硝酸铜。
(1)方法②中被氧化的铜与被还原的硝酸的物质的量之比是 。
(2)“绿色化学”是当今社会提出的一个新概念。在“绿色化学”工艺中,杜绝污染源,提高原子利用率是绿色化学的重要衡量指标。请从“绿色化学”和经济效益角度考虑,大量制取硝酸铜宜采用上述第 (填序号)种方法,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质是按化合物、单质、混合物的顺序排列的是
A. 烧碱、液态氧、碘酒 B. 生石灰、白磷、熟石灰
C. 干冰、铁、氯化氢 D. 氮气、胆矾、空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是
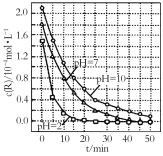
A.R的起始浓度越小,降解速率越大
B.在0~50 min之间,pH=2和pH=7时R的降解百分率相等
C.溶液酸性越强,R的降解速率越小
D.在20~25 min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.标准状况下,1mol石墨的体积约是22.4L
B.常温常压下,44 g CO2和28 g CO所占的体积相同
C.非标准状况下,1mol任何气体的体积都不可能是22.4L
D.当微粒数目相同时,气体物质的体积主要决定于微粒本身的大小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质所发生的化学反应中,由于反应物的用量不同而得到不同产物的是
①铁与稀硝酸 ②硫酸铜溶液与氨水 ③碳酸钠溶液与稀盐酸 ④铁与氯气
A. ①②③ B. ①②③④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A.碳酸钙溶于醋酸:CaCO3+2H+![]() Ca2++CO2↑+H2O
Ca2++CO2↑+H2O
B.澄清石灰水与过量小苏打溶液混合:Ca2++OH-+HCO3-![]() CaCO3↓+H2O
CaCO3↓+H2O
C.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O![]() AlO2-+4NH4++2H2O
AlO2-+4NH4++2H2O
D.氯化亚铁溶液中通入氯气:2Fe2++Cl2![]() 2Fe3++2Cl-
2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压,甲容器中CO2气体与乙容器中CO气体所含的原子总数相等,则甲乙两容器的体积比为( )
A.1:2 B.2:1 C.3:2 D.2:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com