
SO2和Cl2都具有漂白性,若将等物质的量的这两种气体同时作用于潮湿的有色物质,可观察到有色物质( )
A.立刻褪色 B.慢慢褪色 C.先褪色,后复原 D.颜色不褪
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
下列物质的分类合理的是
A.氧化物:CuO、NO、SO2、H2O
B.碱:NaOH、KOH、Ba(OH)2、Na2CO3
C.碱性氧化物:Na2O、CaO、Al2O3、Na2O2
D.电解质:KNO3 、Cl2、HCl 、BaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
硫—碘循环分解水制氢主要涉及下列反应:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI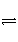
 H2+I2
H2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
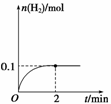
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
0~2 min内的平均反应速率v(HI)=________。该温度下,H2(g)+I2(g)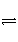
 2HI(g)的平衡常数K=________。
2HI(g)的平衡常数K=________。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数
b.HI的平衡浓度
c.达到平衡的时间
d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知2H2(g)+O2(g)===2H2O(l)
ΔH=-572 kJ·mol-1
某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为
________。
查看答案和解析>>
科目:高中化学 来源: 题型:
1)有下列四种微粒:①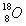 ②
② ③
③ ④
④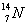 (用序号填空)
(用序号填空)
I.按原子半径由大到小顺序排列是_________________。
II.微粒中质子数小于中子数的是________________。
III.在化合物中呈现的化合价的数值最多的是 ________________。
IV.能形成X2Y2型化合物的是____________,能形成X3Y2型化合物的是____________。
(2)已知An+、B(n+1)+、Cn-、D(n+1)-都具有相同的电子层结构,则A、B、C、D的离子半径由大到小的顺序是__ ________,原子序数由大到小的顺序是_ ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列说法正确的是 ( )
A.标准状况下,5.6 L三氧化硫含有的分子数为0.25NA
B.标准状况下,14 g氮气含有的核外电子数为5NA
C.标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的分子总数均为NA
D.标准状况下,铝跟氢氧化钠溶液反应生成1 mol氢气时,转移的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)0.5molCH4的质量是________,在标准状况下的体积为________;含________个氢原子。
(2)将标准状况下22.4 L的HCl溶于水配成200 mL的溶液,所得溶液的物质的量浓度为________;配制300 mL 0.5 mol·L-1氯化钠溶液,需要1.5 mol·L-1的氯化钠溶液的体积是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差4,戊的单质是空气中含量最多的成分,,丁与辛属同周期元素,
 (1)用元素符号表示甲、乙、丁的金属性从强到弱的顺序 ;
(1)用元素符号表示甲、乙、丁的金属性从强到弱的顺序 ;
(2)用元素符号表示辛、己、戊的原子半径从大到小的顺序 ;
(3)丙与庚的原子核外电子数相差 ;
(4)戊单质电子式为 ,写出一种含戊、己两种元素的离子化合物的化学式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙为单质,它们的转化关系如下图所示(某些条件和部分产物已略去)。下列说法不正确的是( )
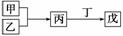
A.若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物
B.若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙可能为Na2O2
C.若丙、丁混合产生白烟,且丙分子为18电子分子,丁分子为10电子分子,则乙的水溶液可能具有漂白作用
D.若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序一定为甲<丙<戊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com