
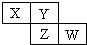
 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A. | X的非金属性比Y的强 | |
| B. | Y的原子半径比Z的原子半径大 | |
| C. | Z的最高价氧化物的水化物为强酸 | |
| D. | W的单质可与Y的氢化物生成两种强酸 |
分析 X、Y、Z、W均为短周期元素,Y原子的最外层电子数是内层电子数的3倍,则Y原子有2个电子层,所以Y为氧元素,根据X、Y、Z、W在周期表中相对位置可知,X为氮元素,Z为硫元素,W为氯元素.结合元素性质的递变规律分析解答.
解答 解:X、Y、Z、W均为短周期元素,Y原子的最外层电子数是内层电子数的3倍,则Y原子有2个电子层,所以Y为氧元素,根据X、Y、Z、W在周期表中相对位置可知,X为氮元素,Z为硫元素,W为氯元素.
A、同一周期原子序数越大,非金属性越强,故非金属性:Y>X,故A错误;
B、同一主族,原子序数越大,半径越大,由于原子序数Z>Y,故半径Z>Y,故B错误;
C、硫酸为强酸,故C正确;
D、氯气与水反应生成HCl和HClO,其中HCl为强酸,HClO为弱酸,故D错误,
故选C.
点评 本题主要考查的是位置、结构、性质的应用,Y是学生解答本题的突破口,明确短周期及元素在周期表中的位置来推断.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯原子的结构示意图: | |
| B. | N2的电子式: | |
| C. | CH4分子的比例模型: | |
| D. | 用电子式表示氯化氢分子的形成过程: |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
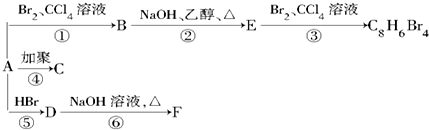
 ,D
,D ,E
,E ,
, +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和乙烷都能在空气中燃烧而被氧气氧化,具有强还原性,所以它们也能被强氧化剂高锰酸钾氧化 | |
| B. | 苯和乙烯都易发生加成反应,乙烷能发生取代反应 | |
| C. | 将苯与浓硝酸混合共热可制得硝基苯,属加成反应 | |
| D. | 苯分子为平面正六边形结构,6个碳原子之间的键完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是某兴趣小组探究不同条件下化学能转变为电能的装置
如图是某兴趣小组探究不同条件下化学能转变为电能的装置查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把铜片和铁片紧靠在一起浸入稀硫酸中,铁片表面出现气泡 | |
| B. | 用锌片做阳极铁片做阴极,电解氯化锌溶液,铁片表面出现一层锌 | |
| C. | 把铜片插入三氯化铁溶液中,在铜片表面出现一层铁 | |
| D. | 把少量锌粒放入盛有足量的盐酸试管中,加几滴氯化铜溶液,气泡放出速率加快,生成氢气的总量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
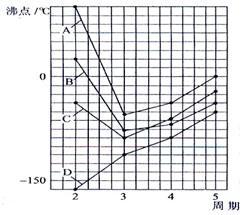 如图四条曲线分别表示ⅣA、VA、ⅥA、ⅦA族元素的气态氢化物的沸点,曲线A、B、C、D表示的气态氢化物(写化学式)分别是H2O,HF,NH3,CH4,同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因a同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.曲线A、B、C中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物的沸点,其原因b第二周期元素的氢化物分子间存在氢键.
如图四条曲线分别表示ⅣA、VA、ⅥA、ⅦA族元素的气态氢化物的沸点,曲线A、B、C、D表示的气态氢化物(写化学式)分别是H2O,HF,NH3,CH4,同一族中第3、4、5周期元素的气态氢化物沸点依次升高,其原因a同一族中第4、5周期元素气态氢化物都不含氢键且分子间作用力大于第三周期氢化物.曲线A、B、C中第2周期元素的气态氢化物的沸点显著高于第3周期元素气态氢化物的沸点,其原因b第二周期元素的氢化物分子间存在氢键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com