
 密闭容器中充入2molA气体和1molB气体,在一定条件下发生反应:2A(g)+B(g)
密闭容器中充入2molA气体和1molB气体,在一定条件下发生反应:2A(g)+B(g)  2C(g),经4 s后达到平衡状态
2C(g),经4 s后达到平衡状态 ,在相同温度下测得容器内混合气体的压强是反应前的5/6,
,在相同温度下测得容器内混合气体的压强是反应前的5/6, 3)达到平衡时,A的转化率。
3)达到平衡时,A的转化率。科目:高中化学 来源:不详 题型:单选题
 装入带活塞的密闭容器中,当反应
装入带活塞的密闭容器中,当反应 达到平衡后,慢慢压缩,下列叙述正确的是
达到平衡后,慢慢压缩,下列叙述正确的是| A.体积减半,则压强为原来的两倍 |
| B.平衡向右移动,混合气体的颜色一定会变浅 |
| C.体积减半,压强增大,但小于原来的2倍 |
| D.平衡向右移动,混合气体密度不变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 G的离子方程式 。
G的离子方程式 。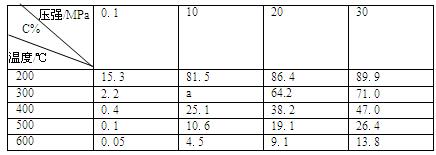

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
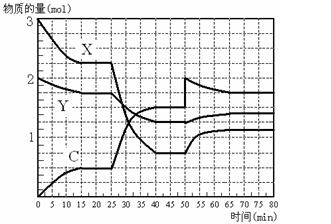
 2C(g)。若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法,其中正确的是
2C(g)。若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法,其中正确的是| A.①③ | B.①④ | C.②③ | D.③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.给硫化氢水溶液中加碱有利于S2-的生成 |
| B.加入催化剂有利于氨的氧化反应 |
| C.高压有利于合成氨反应 |
| D.500℃左右比室温更利于合成氨的反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。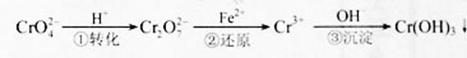

 O
O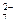
 和CrO
和CrO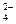 的浓度相同
的浓度相同 O
O ) ="v" (CrO
) ="v" (CrO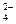 )
) O
O 离子,需要 mol的FeSO
离子,需要 mol的FeSO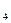 ·7H
·7H O。
O。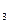 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡:
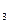 的溶度积
的溶度积 ,要使c(Cr3+)降至10
,要使c(Cr3+)降至10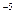 mol/L,溶液的pH应调至 。
mol/L,溶液的pH应调至 。 O
O 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)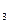 沉淀。
沉淀。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是
C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是| A.容器内的压强不随时间而变化 | B.混合气体的密度不再随时间而变化 |
| C.A的质量不再改变 | D.平衡混合气体的平均相对分子质量不再改变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com