
| A. | Fe2O3 | B. | Fe3O4 | C. | Fe4O5 | D. | Fe6O7 |
分析 设铁的氧化物为FexOy,根据电子守恒可知,FexOy被还原Fe3+转移的电子数和SO3转移的电子数相等.
解答 解:FexOy中Fe的平均化合价为+$\frac{2y}{x}$,被还原为Fe2+,根据电子守恒可知,转移的电子数和SO3转移的电子数相等.标准状况下112mL SO3转移电子数为$\frac{0.112L}{22.4L/mol}$×2=0.01mol.则有:$\frac{1.52g}{(56x+16y)g/mol}$×($\frac{2y}{x}$-2)×x=0.01mol,解得$\frac{x}{y}$=$\frac{4}{5}$,
故选:C.
点评 本题考查氧化还原反应计算,注意氧化还原反应计算中电子转移守恒运用,本题中注意平均化合价的应用,侧重考查学生的分析计算能力.


科目:高中化学 来源: 题型:解答题
| 物质 | H2 | CO | CH3OH |
| 浓度/mol•L-1 | 0.2 | 0.1 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
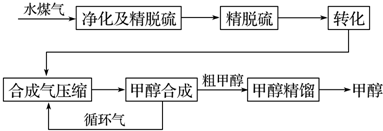
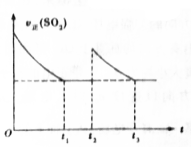 一定温度下,密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g)△H<0.测得v正(SO2)随反应时间(t)的变化如图所示.下列有关说法正确的是( )
一定温度下,密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g)△H<0.测得v正(SO2)随反应时间(t)的变化如图所示.下列有关说法正确的是( )| A. | t2时改变的条件是:只加入一定量的SO2 | |
| B. | t1时平衡常数K1大于t3时平衡常数K2 | |
| C. | t1时平衡混合气的$\overline{{M}_{1}}$大于t3时平衡混合气的$\overline{{M}_{2}}$ | |
| D. | t1时平衡混合气中的SO3的体积分数等于t3时平衡混合气中SO3的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.5 mol/L NaHCO3溶液中含有的HCO3-数目小于0.5 NA | |
| B. | 11.2 g 铁粉与硝酸反应失去电子数一定为0.6 NA | |
| C. | 25℃时,pH=13的 Ba(OH)2溶液中含有的OH-数目为0.2 NA | |
| D. | 46 g甲苯含有C=C双键的数目为1.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无水乙酸和乙醇共热制取乙酸乙酯 | |
| B. | 将苯逐滴滴入浓硝酸中,并用沸水浴加热制取硝基苯 | |
| C. | 将铜丝在酒精灯上加热后,立即伸人无水乙醇中,铜丝恢复原来的红色 | |
| D. | 淀粉用酸催化水解后的溶液加入新制银氨溶液,水浴加热,可看到有银镜出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
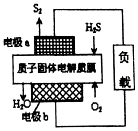
| A. | 电极a为电池的负极 | |
| B. | 电极b上发生的电极反应为O2+4H++4e-═2H2O | |
| C. | 若电路中通过2mol电子,则电池内部释放632kJ热量 | |
| D. | 若有17gH2S参与反应,则会有1molH+经质子膜进入正极区 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com