
【题目】当前能源危机是一个全球性问题,开源节流是应对能源危机的重要举措。
(1)下列做法有利于能源“开源节流”的是________(填字母)。
A.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
B.大力开采煤、石油和天然气以满足人们日益增长的能源需求
C.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
D.减少资源消耗,加大资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。则在通常状况下,金刚石和石墨相比较,________(填“金刚石”或“石墨”)更稳定,石墨的燃烧热ΔH=________。

(3)已知:N2、O2分子中化学键的键能分别是946 kJ/mol、497kJ/mol。N2(g)+O2(g)=2NO(g) ΔH=+180kJ/mol。NO分子中化学键的键能为__________________kJ/mol。
(4)综合上述有关信息,请写出用CO除去NO生成无污染气体的热化学方程式:________________。
(5)已知Na2SO4·10H2O![]() Na2SO4·nH2O+(10-n)H2O。将装有芒硝(Na2SO4·10H2O)的密闭聚乙烯管安装在房屋的外墙内就能达到白天蓄热,使室内保持较低温度,晚上把白天所蓄的热量放出,使室内保持温暖的目的。则白天和晚上的能量转化方式是白天将________能转化为________能,晚上将________能转化为________能。
Na2SO4·nH2O+(10-n)H2O。将装有芒硝(Na2SO4·10H2O)的密闭聚乙烯管安装在房屋的外墙内就能达到白天蓄热,使室内保持较低温度,晚上把白天所蓄的热量放出,使室内保持温暖的目的。则白天和晚上的能量转化方式是白天将________能转化为________能,晚上将________能转化为________能。
【答案】ACD石墨-393.5 kJ·mol-1631.52NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746 kJ·mol-1热化学化学热
【解析】
(1)只要能减少化石燃料等资源的使用都属于开源节流,ACD能减少化石燃料的使用,B大力开采煤、石油和天然气,不能减少化石燃料的使用,故选 ACD。(2)图像分析金刚石能量高于石墨,能量越低越稳定,所以说明石墨稳定,图像分析1mol石墨完全燃烧生成1mol二氧化碳放出的热量为110.5+283.0=393.5kJ。 (3)根据氮气和氧气分子中化学键的键能分别是946 kJ/mol、497kJ/mol和N2(g)+O2(g)=2NO(g) ΔH=+180kJ/mol,可设一氧化氮分子中化学键的键能为x,则有946+497-2x=180,x= 631.5; (4). ①C(石墨,s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1②C(石墨,s)+![]() O2(g)=CO(g) ΔH=+-11.05kJ·mol-1 ③N2(g)+O2(g)=2NO(g)ΔH=+180 kJ·mol-1,由盖斯定律分析,方程式①×2-②×2-③得2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746 kJ·mol-1 。 (5)白天吸收热量,将热能转化为化学能,晚上再把白天所蓄的热量放出,即释放热量,将化学能变为热能。
O2(g)=CO(g) ΔH=+-11.05kJ·mol-1 ③N2(g)+O2(g)=2NO(g)ΔH=+180 kJ·mol-1,由盖斯定律分析,方程式①×2-②×2-③得2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=-746 kJ·mol-1 。 (5)白天吸收热量,将热能转化为化学能,晚上再把白天所蓄的热量放出,即释放热量,将化学能变为热能。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19g/cm3
质量分数:36.5%
(1)该浓盐酸中HCl的物质的量浓度为__________molL-1。
(2)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.200molL-1的稀盐酸。可供选用的仪器有:A胶头滴管;B量筒;C烧杯;D天平;E玻璃棒。
①配制稀盐酸时,上述仪器中不需要使用的有 (选填字母),还缺少的仪器有__________。
②该学生需要用__________mL量筒量取__________mL上述浓盐酸进行配制。
③配制稀盐酸时,在洗涤操作中,将洗涤液全部移入容量瓶,其目的是__________。
④配制稀盐酸时,在定容操作中,应在距刻度线__________处,改用胶头滴管滴加蒸馏水至液面与__________。
⑤若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”、“偏低”或“无影响”)定容时俯视刻度线__________;定容后经振荡、摇匀、静置,发现液面下降,再加适合的蒸馏水__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3溶液,再分别滴加下图所示的试剂。

下列关于实验现象的解释或结论正确的是
选项 | 实验现象 | 解释或结论 |
A | a中无明显现象 | Na2SO3和H2O2一定不发生反应 |
B | b中加稀H2SO4后才产生淡黄色沉淀 | SO32和S2两种离子一定不能大量共存 |
C | c中加BaCl2溶液后产生白色沉淀且红色褪去 | Ba2++ SO32 == BaSO3↓,使SO32水解平衡逆向移动,红色褪去 |
D | d中产生白色沉淀 | 原Na2SO3溶液中含有SO42 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,观察到电流计指针偏转;M棒变粗;N棒变细,由此判断表中所列M、N、P物质,其中可以成立的是
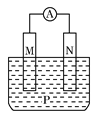
M | N | P | |
A | Zn | Cu | 稀H2SO4溶液 |
B | Cu | Fe | 稀HCl溶液 |
C | Ag | Zn | AgNO3溶液 |
D | Zn | Fe | Fe(NO3)3溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
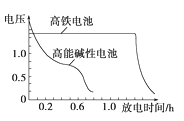
【题目】(1)高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图是高铁电池的模拟实验装置:

①该电池放电时正极的电极反应式为_______________________________________;若维持电流强度为1 A,电池工作十分钟,理论上消耗Zn______ g(计算结果保留一位小数,已知F=96500 C·mol-1)。
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向______(填“左”或“右”)移动;若用阳离子交换膜代替盐桥,则钾离子向________(填“左”或“右”)移动。
③下图为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有__________。
(2)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是__________________________,A是________。

(3)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如图所示。该电池中O2-可以在固体介质NASICON (固溶体)内自由移动,工作时O2-的移动方向________(填“从a到b”或“从b到a”),负极发生的电极反应式为__________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据所学知识,回答下列问题:
某学习小组用如下图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题。
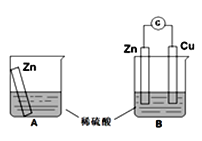
(1)B中Zn板是_________极,发生的电极反应是_________________,Cu板上的现象是___________;
(2)从能量转化的角度来看, A中是将化学能转变为_________,B中主要是将化学能转变为_________;
(3)该小组同学反思原电池的原理,其中观点正确的是_________;
A.原电池反应的过程中一定有电子转移
B.电极一定不能参加反应
C.原电池装置中的电子流向:负极→外线路→正极→电解质→负极
D.氧化反应和还原反应可以拆开在两极发生
(4)在B中,当导线中有1mol电子通过时,理论上的两极变化是_________。
A.锌片溶解32.5g B.锌片增重32.5g
C.铜片上析出2gH2 D.铜片上析出1mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的工业加工过程中,可利用CO和H2合成用途广泛的化工原料甲醇,能量变化如图所示。下列说法正确的是

A. 该反应是吸热反应
B. 1molCH3OH所具有的能量为90.lkJ·mol-1
C. CO(g)+2H2(g) ![]() CH3OH(l) △H=-90.1kJ·mol-1
CH3OH(l) △H=-90.1kJ·mol-1
D. 1mol CO和2mol H2断键所需能量小于1mol CH3OH断键所需能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)SO2和NOx都是大气污染物。采取还原法,用炭粉可将氮氧化物还原。
已知:N2(g)+O2(g) = 2NO(g)ΔH=+180.6 kJ·mol-1
C(s)+O2(g) = CO2(g)ΔH=-393.5 kJ·mol-1
则反应C(s)+2NO(g) = CO2(g)+N2(g) ΔH=________kJ·mol-1。
(2)利用氨水可以将SO2和NO2吸收,原理如下图所示:

NO2被NH4HSO3溶液吸收的离子方程式是_____________________________。
(3)家用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出表示丁烷燃烧的热化学方程式:____________。
(4)已知:C(s)+O2(g)═CO2(g)△H=﹣393.5kJmol﹣1
2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJmol﹣1
现有0.2mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比为______。
(5)在一定条件下,可逆反应:mA+nBpC达到平衡,若:
①A、B、C都是气体,减少压强,平衡向正反应方向移动,则m+n__p。(填< > =)
②A、C是气体,增加B的量,平衡不移动,则B为______态。
③A、C是气体,而且m+n=p,增大压强可使平衡发生移动,则平衡移动的方向是___
④加热后,可使C的质量增加,则正反应是_____反应(填“放热”或“吸热”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com