
在无色透明的强酸性溶液中,能大量共存的是( )
A.Na+、NO3-、Al3+、Cl- B.Na+、CO32-、Ca2+、NO3-
C.K+、SO42-、Cl-、Cu2+ D.Ba2+、Cl-、K+、SO42-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2017届江西省高三上月考三化学卷(解析版) 题型:填空题
研究大气中含硫化合物和含碳化合物的转化对环境保护具有重要意义。
(1)SO2的大量排放会引起严重的环境问题是 ,潮湿条件下,写出大气中SO2转化为HSO3-的方程式 ;
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
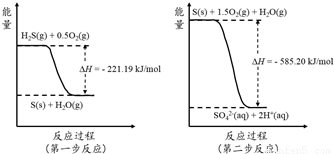
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为 ;
(3)SO2是工业制硫酸的原料之一,一定温度下,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g) 2SO3(g),过程中测定的部分数据见下表:
2SO3(g),过程中测定的部分数据见下表:
时间/min | n(SO2)/mol | n(O2)/mol |
0 | 0.10 | 0.05 |
4 | 0.04 | 0.02 |
6 | 0.02 | |
8 | 0.01 |
①反应在0-4min内的平均速率为v(SO2)= ;
②此温度下该反应的化学平衡常数K= ;
③8min时,维持温度不变,向反应容器中再通入0.02mol SO2(g) 和0.01mol O2(g),重新达到平衡时混合气体中SO2的百分含量将 (填“减小”、“增大”或“不变”)。
和0.01mol O2(g),重新达到平衡时混合气体中SO2的百分含量将 (填“减小”、“增大”或“不变”)。
(4)科学家用氮化镓材料与铜组装如下图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4的反应。
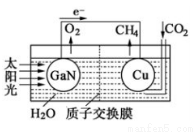
写出铜电极表面的电极反应式 ,为提高该人工光合系统的工作效率,可向装置中加入少量 (填“盐酸”或“硫酸”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省等三校高一上期中化学卷(解析版) 题型:实验题
为了分离H2和SO2,并分别得到干燥的气体,某学生设计了一个实验装置。(a、b为活塞,且每个装置中的溶液均过量。已知Na2SO3+H2SO4=Na2SO4+H2O+SO2↑)
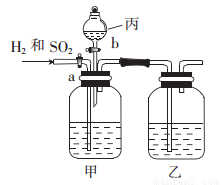
(1) 仪器丙的名称是____________。
(2) 甲容器中盛____________;乙容器中盛___________。(填字母)
A.浓硫酸 B.稀硫酸 C.氢氧化钠溶液 D.氯化钡溶液
(3) 实验时关闭b,打开a,一段时间后甲中的溶质是__________。
(4) 当分离完一种气体后,关闭_________(填“a”或“b”,下同),打开_________,这样得到的气体是____________。
查看答案和解析>>
科目:高中化学 来源:2017届西藏山南二中高三上11月月考化学试卷(解析版) 题型:选择题
19世纪中叶,门捷列夫的突出贡献是( )
A. 提出原子学说 B. 发现元素周期律 C. 提出分子学说 D. 发现氧气
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次段考化学卷(解析版) 题型:实验题
一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高,其主要流程如下:
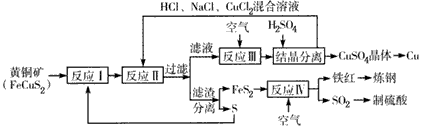
注:反应II的离子方程式为Cu2+ +CuS+4Cl- ═2[CuCl2]-+S↓
请回答下列问题;
(1)反应I的产物为 (填化学式)。
(2)反应Ⅲ的离子方程式为 。
(3)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其可能的原因是 。
(4)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均成酸性,相同条件下,同浓度的两种水溶液c(SO32-)较小的是 。
(5)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe2(SO4)3 溶液完全反应后,用浓度为0.02000mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00Ml。 已知:Cr2O72- +Fe2+ +H+→Cr3+ +Fe3+ +H2O(未配平)反应IV所得气体中SO2的体积分数为 。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次段考化学卷(解析版) 题型:选择题
海洋中有丰富的食品、矿产、能源、药物、和水产资源等(如图所示),下列有关说法正确的是
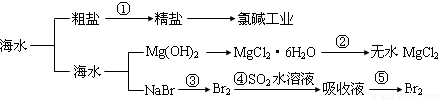
A.第①步中除去粗盐中的SO42- 、Ca2+ 、Mg2+ 、Fe3+ 等杂质,加入的药品顺序为:
Na2CO3 溶液→NaOH溶液→BaCl2 溶液→过滤后加盐酸
B.工业上金属钠是通过氯碱工业制取
C.从第③步到第⑤步的目的是为了浓缩
D.在第③④⑤步中溴元素均被氧化
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上期中化学卷(解析版) 题型:选择题
下列关于漂白粉的叙述正确的是
A.漂白粉的有效成分是Ca(ClO)2和CaCl2 B.漂白粉在空气中久置后会变质
C.漂白粉是由Cl2与烧碱制得的 D.在使用漂白粉时应用浓盐 酸
酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com