
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
分析 分子式为C6H12的烯烃,含有1个C=C双键,分子结构中含有3个“-CH3”原子团,可以看做3个甲基取代丙烯中的3个H原子,结合丙烯的结构确定甲基的可能位置书写判断.
解答 解:分子式为C6H12的烯烃,含有1个C=C双键,分子结构中含有3个“-CH3”原子团,可以看做3个甲基取代丙烯中的3个H原子,符合条件的结构有:CH2=CHC(CH3)3、CH2=C(CH3)CH(CH3)2、CH3CH=CHCH(CH3)2、CH3CH=C(CH3)CH2CH3、(CH3)2C=CHCH2CH3,故共有5种,故选A.
点评 本题考查限制条件同分异构体的书写,难度中等,注意利用取代方法进行的书写.


科目:高中化学 来源: 题型:推断题
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为  ; ;③能与水在一定条件下反应生成物质C |
| B | ①由C和H两种元素组成; ②比例模型为  |
| C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与D反应生成相对分子质量为100的酯 |
| D | ①由C、H、O三种元素组成; ②球棍模型为 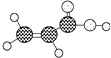 |
 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$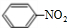 +H2O
+H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉[(C6H10O5)n]与纤维素[(C6H10O5)n]--互为同分异构体 | |
| B. | CH4与 C2H4--互为同系物 | |
| C. | O2与O3--同一物质 | |
| D. | 136C与126C--不同核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单独利用焓变的数据或熵变的数据就能判断化学反应能否自发进行 | |
| B. | 在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态 | |
| C. | 利用反应热数据的大小可以判断不同反应的反应速率的大小 | |
| D. | 利用溶液的pH与7的大小关系,可以判断任何温度下溶液的酸碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 常温常压下,11.2LO2所含的原子数为NA | |
| C. | 0.5mol纯硫酸所含有的氧原子数与NA个CO2分子中所含有的氧原子数相等 | |
| D. | 标准状况下,11.2LCCl4含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
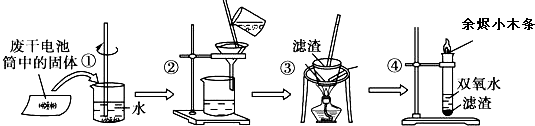
| A. | 步骤①的操作名称是溶解 | |
| B. | 步骤②中玻璃棒的作用是引流 | |
| C. | 步骤③的操作名称是蒸发 | |
| D. | 步骤④中的双氧水加入滤渣后迅速产生大量气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH | B. | CO2和CH3COCH3 | ||
| C. | CO2和CH3CH2COOH | D. | HCOOH和CH3CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | 仅①②③④⑤ | C. | 仅①②③④ | D. | 仅①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
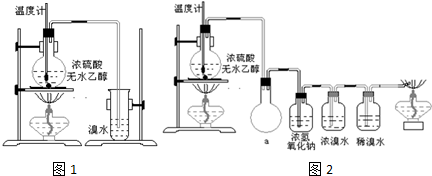
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com