
【题目】下列仪器使用前必须检查是否漏水的有 (填序号)
A.容量瓶
B.蒸馏烧瓶
C.分液漏斗
D.量筒
E.蒸发皿.
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,完成下列填空:
(1)1molCH4含 碳原子________mol,含氢原子___________mol。
(2)标准状况下,0.5mol个CO2分子所占有的体积为________。
(3)标准状况下,33.6LH2所含的分子数目为________。
(4)34g H2O2的物质的量为________; 0.5molH2SO4的质量为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以软锰矿(主要成分为MnO2) 为主要原料制备高锰酸钾(KMnO4)的工艺流程如下:
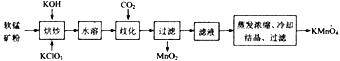
回答下列问题:
(1)原料软锰矿在使用之前通常需粉碎,其目的是_________________________________。
(2)“烘炒”时是将混合物放入某种材质的坩埚内,混合均匀,小火加热至熔融,有K2MnO4和KCl生成,则烘炒过程中发生反应的化学方程式为________________;“烘炒”时所用坩埚的材质可以选用_______(填字母)。
a.石英 b.氧化铝 c.硅酸盐陶瓷 d.铁
(3)已知水溶过程中无化学反应发生,通入CO2使反应体系呈中性或弱酸性即可发生歧化反应,则歧化时发生反应的氧化产物与还原产物的物质的量之比为_______________。
(4)对滤液进行蒸发浓缩时,温度不宜超过60℃,其原因是_________________;将蒸发温度控制在60℃左右的最佳操作方法是_______________________。
(5)流程中可以循环利用的物质是___________________。
(6)用CO2歧化法将K2MnO4转化为KMnO4属于传统工艺,现代工艺多采用电解法,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为_________________;与“CO2歧化法”相比,“电解法”的显著优点是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、脂肪和蛋白质是维持人体生命活动必需的三大营养物质。下列说法错误的是
A.纤维素、淀粉、油脂、蛋白质都是高分子化合物
B.淀粉水解的最终产物能发生银镜反应
C.人体不具备水解纤维素的能力,但可以水解淀粉
D.油脂能发生皂化反应,生成甘油和高级脂肪酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g)![]() 2D(g)△H=QkJ/mol。相关条件和数据见下表:
2D(g)△H=QkJ/mol。相关条件和数据见下表:
实验编号 | 实验I | 实验II | 实验III |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 50 | 30 |
n(D)平衡/mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K2 | K3 |
下列说法正确的是
A. 升高温度能加快反应速率的原理是降低了反应的活化能,使活化分子百分数提高
B. 实验III达平衡后,保持其他条件不变,再向容器中通入1molA和1molD,平衡不移动
C. 实验III达平衡后容器内的压强是实验1的9/10倍
D. K3>K2>K1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I(化学反应原理)
甲、乙两池电极材料都是铁棒与碳棒如图。若两池中均盛放氯化钠溶液,反应一段时间后,请回答下列问题:

(1)甲池中铁作______极,乙池中铁作_______极。
(2)甲池中铁电极反应__________________,碳电极反应________________。
(3)乙池中总反应化学方程式__________________。
II(化学与生活)
材料与生活、生产息息相关,目前使用的材料主要有:金属材料、传统无机非金属材料、新型无机非金属材料、高分子材料、复合材料等。
(1)硅酸盐材料是重要的传统无机非金尾材料,也是日常生活、交通工具、建筑行业等不可缺少的材料之一。下列不属于硅酸盐产品的是___________(填写序号)
①光导纤维 ②水泥 ③玻璃 ④陶瓷
(2)玻璃是重要的建筑和装饰材料,玻璃属于______(填“纯净物”或“混合物”)。有些玻璃的花纹是利用氢氟酸对普通玻璃中的二氧化硅的腐蚀作用而制成的,写出该反应的化学方程式______。
(3)氮化硅是一种高温陶瓷材料,它的硬度大、熔点高,化学性质稳定。工业上普遍采用高纯硅与纯氮在1300℃反应获得氮化硅,该反应属于化学反应基本类型中的_____反应;已知氮化硅中硅元素的化合价为+4价,则氮化硅的化学式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I(化学反应原理)
(1)25℃,100 mL氢氧化钡溶液中含有1×10-3 mol的OH-,该溶液的pH为_________。
(2)常温下,CuCl2的水溶液呈_____(填“酸”、“中”或“碱”)性,原因是_______________(用离子方程式表示)。
(3)把AlCl3溶液在空气中蒸干、灼烧,最后得到的主要固体产物是_________。
(4)等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液中
c(Na+)________c(CH3COO-)(填“ >”、“=”或“<” )。
II(化学与生活)
有四种常见药物 ①阿司匹林 ②青霉素 ③胃舒平 ④麻黄碱.请回答:
(1)某同学胃酸过多,应选用的药物是______(填序号),抗酸药是治疗胃酸过多的一类药品,请写出一种抗酸药(有效成分是碳酸钙)中和胃酸过多的化学反应方程式:___________________________。
(2)由于具有兴奋作用,国际奥委会严禁运动员服用的药物是_________(填序号)。
(3)从用药安全角度考虑,使用前要进行皮肤敏感性测试的药物是_______(填序号)。
(4)滥用药物会导致不良后果,如过量服用________(填序号)会出现水杨酸中毒,应立即停药,并静脉注射___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列五种短周期元素的电离能数据(单位:kJ·mol-1),回答下列问题。

(1)在这五种元素中,最可能处于同一族的两种元素是______________(填元素符号),S元素最可能是________区元素。
(2)基态Q元素原子的价电子排布式是___________。Q和T同周期,化合物QT中T元素的化合价为____________;第一电离能介于Q、T之间的同周期元素有____________种。
(3)化合物RT3中含有的化学键类型为____________,RT3中阴离子的几何构型为__________。
(4)下列元素中,化学性质和物理性质与U元素相似的是________(填序号)。
A.硼 B.铍 C.锂 D.氦 E.碳
(5)R的某种氧化物X的晶胞结构如图所示,晶胞参数a=0.566nm,X的化学式为________:晶体X的密度是____________(g·cm-3)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种优良的消毒剂,常将其制成NaClO2固体,以便运输和贮存,过氧化氢法备NaClO2固体的实验装置如图所示。
已知:①2NaC1O3+H2O2+H2SO4=2C1O2↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
②ClO2熔点-59℃、沸点11℃,浓度过高时易发生分解;
③H2O2沸点150℃
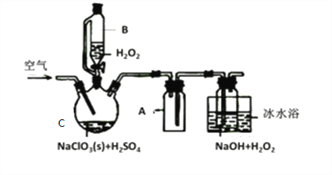
(1)仪器C的名称是__________________,仪器A的作用是_________________,冰水浴冷却的目的是_____________________和___________________________。
(2)该装置不完善的方面是________________________。
(3)空气流速过快或过慢,均降低NaClO2产率,试解释其原因,空气流速过慢时,___________;空气流速过快时,________________。
(4)Cl-存在时会催化ClO2的生成。反应开始时在C中加入少量盐酸,ClO2的生成速率大大提高,并产生微量氯气。该过程可能经两步完成,请将其补充完整:
①_____________________________(用离子方程式表示)
②H2O2+Cl2=2Cl-+O2+2H+
(5)NaClO2纯度测定:
①准确称取所得NaClO2样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(C1O2-的产物为Cl-),将所得混合液配成250mL待测溶液;
②取25.00mL待测液,用2.0mol·L-1Na2S2O3标准液滴定(I2+2S2O32-=2I-+S4O62-),以淀粉溶液做指示剂,达到滴定终点时的现象为__________________________,重复滴定3次,测得Na2S2O3标准液平均用量为20.00mL,则该样品中NaClO2的质量分数为_________________。(M(NaClO2)=90.5g/mol)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com