

科目:高中化学 来源:2012届浙江省杭州市学军中学高三上学期第一次月考化学试卷 题型:实验题
( 8分)亚铁盐在空气中易被氧化,但形成复盐可稳定存在。硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]是一种重要化学试剂,实验室可用纯铁片来制
8分)亚铁盐在空气中易被氧化,但形成复盐可稳定存在。硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]是一种重要化学试剂,实验室可用纯铁片来制 取硫酸亚铁铵,流程如下:
取硫酸亚铁铵,流程如下:
请回答下列问题:
(1)操作Ⅰ的名称是 ,所用主要仪器和用品有(铁架台、铁圈除外)
,所用主要仪器和用品有(铁架台、铁圈除外)
。
(2)若A物质为CuSO4,其加入的目的是 ,则固体B的成分为 。
(3)加少量硫酸可以调节pH为 1~2,其作用是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省九江市七校高三第二次联考化学试卷(解析版) 题型:填空题
亚铁盐在空气中易被氧化,但形成复盐可稳定存在。硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]是一种重要化学试剂,实验室可用纯铁片来制取硫酸亚铁铵,流程如下:
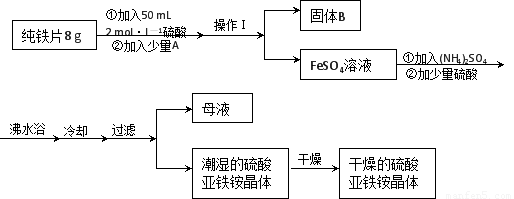
请回答下列问题:
(1)操作Ⅰ的名称是 ???????? ,所用主要仪器和用品有(铁架台、铁圈除外)??????????? 。
(2)若A物质为CuSO4,其加入的目的是???????????????? ,则固体B的成分为????????? 。
(3)加少量硫酸可以调节pH为 1~2,其作用是??????????????????????????????????????? 。
查看答案和解析>>
科目:高中化学 来源:2012年鲁科版高中化学选修6 3.1 物质组分的检验练习卷(解析版) 题型:实验题
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1 将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2 向处理过的铁屑中加入过量的3 mol·L-1H2SO4溶液,在60 ℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3 向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有________(填仪器编号);
①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研钵 ⑥玻璃棒 ⑦酒精灯
(2)在步骤2中所加的硫酸必须过量,其原因是
________________________________________________________________________;
(3)在步骤3中,“一系列操作”依次为________、________和过滤;
(4)本实验制得的硫酸亚铁铵晶体常含有Fe3+杂质。检验Fe3+常用的试剂是________________________________________________________________________,可以观察到的现象是
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三元月双周练习化学试卷 题型:实验题
(12分)硫酸亚铁铵(NH4)2SO4•FeSO4•6H2O是一种重要化学试剂,实验室用除去锌镀层的铁片来制取硫酸亚铁铵,流程如下:
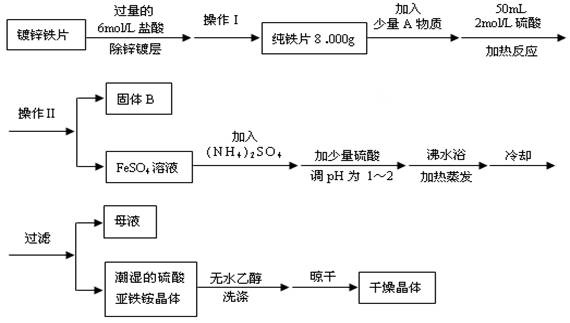
请回答下列问题:
(1)确定锌镀层被除去的标志是 ;
计算上述铁片锌镀层的厚度,不需要的数据是 (填编号)。
a.锌的密度ρ(g/cm3) b.镀锌铁片质量m 1(g) c.纯铁片质量m 2(g)
d.镀锌铁片面积S(cm2) e.镀锌铁片厚度h(cm)
(2)上述流程中:操作Ⅰ是取出铁片、 、 、称量。
(3)A物质可以为 (填编号)。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
(4)用无水乙醇洗涤潮湿的硫酸亚铁铵晶体是为了除去晶体表面残留的水分,不用加热烘干的原因是 。
(5)鉴定所得晶体中含有Fe2+、NH4+、SO42-离子的实验方法正确的是 (填编号)。
a.取少量样品于试管,加水溶解,通入适量Cl2,再加KSCN溶液,观察现象
b.取少量样品于试管,加水溶解,加入NaOH溶液,露置于空气中,观察现象
c.取少量样品于试管,加水溶解,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸置于试管口,观察试纸颜色的变化
d.取少量样品于试管,加水溶解,加入盐酸后再加入BaCl2溶液,观察现象
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江西省高三下学期第一次模拟考试(理综)化学部分 题型:化学题
根据废水中所含有害物质的不同,工业上有多种废水的处理方法。

(1)①废水I若采用CO2处理,离子方程式是 。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO-3)越大,净水效果越好,这是因为
。
③废水III中的汞元素存在如下转化(在空格上填相应的化学式):
Hg2++ =====CH3Hg++H+我国规定,Hg2+的排放标准不能超过0.05 mg/L。若某工厂排放的废水1 L中含Hg2+3×10-17mo1,是否达到了排放标准 (填“是”或“否”)。
④废水Ⅳ常用C12氧化CN-成CO2和N2,若参加反应的C12与CN-的物质的量之比为5:2,则该反应的离子方程式为 。
(2)化学需氧量(COD)可量度水体受有机物污染的程度,它是指在一定条件下,用强氧化剂处理水样时所消耗的氧化刹的量,换算成氧的含量(以mg/L计)。某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
I.取V1mL水样于锥形瓶,加入10.00 mL 0.2500 mol/L K2Cr2O7溶液。
II.加碎瓷片少许,然后慢慢加入硫酸酸化,混合均匀,加热。
III.反应完毕后,冷却,加指示剂,用c mol/L的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定。终点时消耗硫酸亚铁铵溶液V2 mL。
①I中,量取K2Cr2O7,溶液的仪器是 。
②III中,发生的反应为:Cr2O72-+6Fe2++14 H+==2Cr3++6Fe3++7H2O
由此可知,该水样的化学需氧量COD= (用含c、V1、V2的表达式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com