
分析 由Sn+2HCl═SnCl2+H2↑、SnCl2+2FeCl3═SnCl4+2FeCl2、6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O可知,关系式为3Sn~3SnCl2~6FeCl3~6FeCl2~K2Cr2O7,以此计算n(Sn),再根据m=nM计算m(Sn),利用质量分数定义计算试样中Sn的百分含量.
解答 解:由Sn+2HCl═SnCl2+H2↑、SnCl2+2FeCl3═SnCl4+2FeCl2、6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O可知,关系式为3Sn~3SnCl2~6FeCl3~6FeCl2~K2Cr2O7,
反应中消耗的K2Cr2O7的物质的量为0.100mol/L×0.0160L=1.60×10-3mol,则
3Sn~K2Cr2O7
3 1
n(Sn) 1.60×10-3mol
n(Sn)=1.60×10-3mol×3=0.0048mol,
Sn的质量为:4.8×10-3mol×119g/mol=0.5712,
试样中Sn的百分含量为$\frac{0.5712g}{0.613g}$×100%=93.2%,
答:试样中锡的百分含量为93.2%.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应及物质的量关系为解答的关键,侧重分析与计算能力的考查,注意判断发生的氧化还原反应,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氧的一种核素符号是8O | |
| B. | 1H原子核内有1个中子 | |
| C. | O2和O3互为同位素 | |
| D. | 通常情况下,He和N2化学性质都很稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉加入三氯化铁溶液中 Fe+Fe3+═2Fe2+ | |
| B. | Cl2与水的反应Cl2+H2O═2H++Cl-+ClO- | |
| C. | 铜片插入硝酸银溶液中Cu+Ag+═Cu2++Ag | |
| D. | 大理石溶于醋酸的反应CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
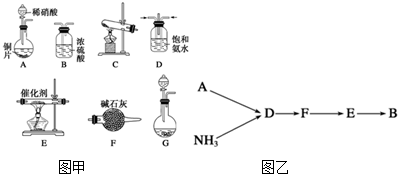
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
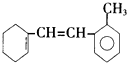
| A. | 分子式为C15H18 | |
| B. | 能使酸性KMnO4溶液褪色,且是氧化反应 | |
| C. | 1mol该物质最多和2molH2加成 | |
| D. | 苯环上的一氯化物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
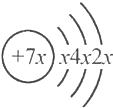 ,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构,下列比较中,正确的是( )
,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构,下列比较中,正确的是( )| A. | 原子序数:a>b>c | B. | 氢化物的稳定性:a>c>d | ||
| C. | 原子半径:d>a>c | D. | 最高价含氧酸的酸性:d>c>a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某温度时,在一个容积为2L的密闭容器中,X,Y,Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )
某温度时,在一个容积为2L的密闭容器中,X,Y,Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )| A. | 反应开始至2min,Z的反应速率为0.10mol•L-1•min-1 | |
| B. | 该反应的化学方程式为3X+Y?2Z | |
| C. | 2min时,反应达最大限度,但化学反应仍在进行 | |
| D. | 反应达到平衡时,压强是开始时的0.9倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二甲醚(CH3OCH4)是一种重要的清洁燃料,工业上利用水煤气合成二甲醚的三步反应如下:
二甲醚(CH3OCH4)是一种重要的清洁燃料,工业上利用水煤气合成二甲醚的三步反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、SO42-、HCO3- | B. | NH4+、K+、SO42-、Cl- | ||
| C. | Na+、Al3+、AlO2-、NO3- | D. | Fe2+、K+、S042-、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com