
【题目】利用废铅蓄电池的铅泥(PbO、Pb及PbSO4等)可制备精细无机化工产品﹣3PbOPbSO4H2O (三盐),主要制备流程如下:
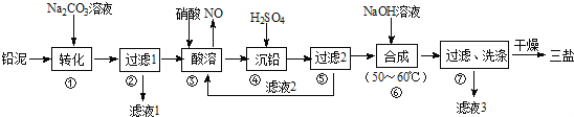
(1)步骤①PbSO4转化为难溶PbCO3的离子方程式为______________.
(2)滤液1和滤液3经脱色、蒸发、结晶可得到的副产品为______________(写化学式).
(3)步骤③酸溶时,其中的铅与硝酸生成Pb(NO3)2及NO的离子方程式为______________;滤液2中溶质主要成分为______________(写化学式).
(4)步骤⑥合成三盐的化学方程式为______________.
(5)步骤⑦洗涤操作时,检验沉淀是否洗涤完全的方法是______________.
【答案】(1)CO32﹣+PbSO4=PbCO3+SO42﹣(2)Na2SO410H2O(或Na2SO4)
(3)3Pb+8H++2NO3﹣=3Pb2++2NO↑+4H2O HNO3
(4)4PbSO4+6NaOH=3Na2SO4+3PbOPbSO4H2O+2H2O
(5)取少量最后一次的洗涤过滤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤完全
【解析】
试题分析:向铅泥中加入Na2CO3溶液,PbSO4转化为难溶PbCO3的离子方程式为CO32-+PbSO4=PbCO3+SO42-,然后过滤得到滤液1为Na2SO4溶液,向滤渣中加入硝酸酸溶,PbO、Pb、PbCO3都与硝酸反应生成 Pb(NO3)2,Pb与硝酸反应还生成NO,铅与硝酸生成Pb(NO3)2及NO的离子方程式为3Pb+8H++2NO3-=3Pb+2NO↑+4H2O,然后向溶液中加入硫酸,生成bSO4沉淀,过滤,滤液2的主要成分是HNO3,向滤渣中加入NaOH溶液,发生反应4PbSO4+6NaOH=3Na2SO4+3PbOPbSO4H2O+2H2O,过滤洗涤干燥得到3PbOPbSO4H2O,滤液3中含有Na2SO4,
(1)通过以上分析知,碳酸钠和硫酸铅发生难溶物的转化,离子方程式为CO32-+PbSO4=PbCO3+SO42-;
(2)通过以上分析知,滤液1和滤液3经脱色、蒸发、结晶可得到的副产品为Na2SO410H2O(或Na2SO4);
(3)通过以上分析知,该离子反应方程式为3Pb+8H++2NO3-=3Pb+2NO↑+4H2O,滤液2中主要成分是未反应的HNO3;
(4)该反应方程式为4PbSO4+6NaOH=3Na2SO4+3PbOPbSO4H2O+2H2O;
(5)该沉淀吸附的离子是硫酸根离子,用盐酸酸化的氯化钡检验,其检验方法为取少量最后一次的洗涤过滤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤完全。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。

(1)写出下列物质的化学式:
A:________,E:________,J:________,G:________.
(2)按要求写方程式:
A与B在高温条件下生成C和D的化学方程式:_________________________;
C转化为I的离子方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
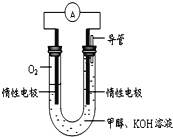
(1)该电池中OH-向_______极移动(填“正”或“负”)
(2)该电池负极的电极反应为___________________
(3)用该电池电解(惰性电极)500 mL某CuSO4溶液,电解一段时间后,为使电解质溶液恢复到原状态,需要向溶液中加入9.8 g Cu(OH)2固体。则原CuSO4溶液的物质的量浓度为_______________,电解过程中收集到标准状况下的气体体积为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Na+ 、Al3+ 、Cl – 、SO42-四种离子,已知Na+ 、Al3+ 、Cl –的个数比为3:2:1,则溶液中Al3+ 与SO42-物质的量之比为( )
A. 1:2 B. 1:4 C. 3:4 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是( )
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中石墨电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期的A、B、C、D四种元素在周期表中均与元素X紧密相邻.已知元素X最高价氧化物的化学式为X2O5,B、D同主族且B元素的原子半径是同族元素中最小的,C的最高价氧化物对应的水化物是强酸.
(1)D元素基态原子的电子排布式为____________.
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为_______________(用相应的元素符号作答).
(3)B、X、D氢化物的沸点由高到低的顺序为_______________(用相应的化学式作答).
(4)E元素是A元素所在周期中电负性最大的,试推测下列微粒的立体构型:
微粒 | EO2﹣ | EO3﹣ |
立体构型名称 |
(5)元素B的一种氢化物B2H4具有重要的用途.有关B2H4的说法正确的是____________.
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
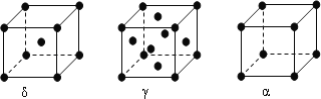
(6)F元素基态原子M层上有5对成对电子,F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如图所示)中F原子的配位数之比为____________,δ、γ、α三种晶胞的边长之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC﹣COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华.为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生.该反应的离子方程式为______________.
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,请配平该反应的离子方程式:
______MnO4﹣+______ H2C2O4+______ H+═______ Mn2++______ CO2↑+______ H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(注:忽略草酸的升华,且夹持装置未标出):
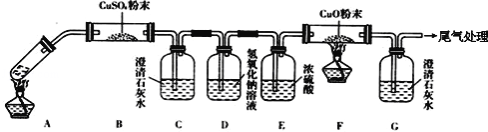
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末有黑色变为红色.据此回答:
上述装置中,D的作用是_________.乙二酸分解的化学方程式为_________.只根据G中澄清石灰水变浑浊能否得出“草酸分解产物中一定有CO”的结论_________(填“能或不能”)若不能应怎样改进?______________.
(4)该小组同学将2.52g草酸晶体(H2C2O42H2O)加入到100mL 0.2mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性(忽略溶液体积变化).则下列关系合理的是_________
A.c(Na+)+c(H+)=c(HC2O4﹣)+c(OH﹣)+c(C2O42﹣)
B.c(HC2O4﹣)+c(C2O42﹣)=0.2molL﹣1
C.c(HC2O4﹣)>c(C2O42﹣)>c(H2C2O4)
D.c(Na+)=c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com