
下表各组物质中,物质之间不可能实现如图所示转化的是
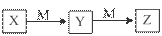
| 选项 | X | Y | Z | M |
| A | NH3 | NO | NO2 | O2 |
| B | Cl2 | FeCl3 | FeCl2 | Fe |
| C | Al | Al(OH)3 | NaAlO2 | NaOH |
| D | NaOH | Na2CO3 | NaHCO3 | CO2 |
 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
已知:
① 在稀碱溶液中,溴苯难发生水解
②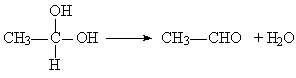
现有分子式为C10H10O2Br2的芳香族化合物X,其苯环上的一溴代物只有一种,其核磁共振氢谱图中有四个吸收峰,吸收峰的面积比为1:2:6:1,在一定条件下可发生下述一系列反应,其中C能发生银镜反应,E遇FeCl3溶液显色且能与浓溴水反应。
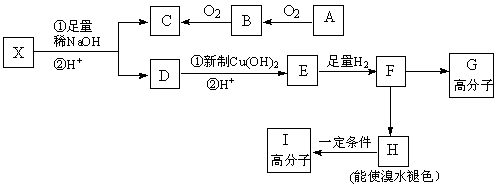

请回答下列问题:
(1)X中官能的名称是 。
(2)F→H的反应类型是 。
(3)I的结构简式为 。
(4)E不具有的化学性质 (选填序号)。
a.取代反应 b.消去反应 c.氧化反应 d.1molE最多能与2molNaHCO3反应
(5)写出下列反应的化学方程式:
① X与足量稀NaOH溶液共热的化学方程式: 。
② F→G的化学方程式: 。
(6)同时符合下列条件的E的同分异构体共有 种,其中一种的结构简式为 。
a.苯环上核磁共振氢谱有两种 b.不能发生水解反应
c.遇FeCl3溶液不显色 d.1molE最多能分别与1molNaOH和2molNa反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色透明溶液可能存在Na+、Fe3+、Ba2+、NO3-、CO32-、HCO3-、SO42-中的几种离子,现有如下操作:
Ⅰ、取适量该溶液加入CaCl2溶液无沉淀,继续滴加盐酸产生无色无味的气体。
Ⅱ、另取该溶液滴加一定量的NaOH溶液有白色沉淀生成。
试回答下列问题:
该溶液中一定存在的离子有______________,一定不存在的离子_____________。
用一个离子方程式表示操作②的实验现象:
________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语或名称表达正确的是
A.亚硫酸的电离方程式:H2SO3 2H++SO
2H++SO
B.乙炔的分子结构模型示意图:
C.H2O2的电子式:
D. 的名称3-甲基-1-丁醇
的名称3-甲基-1-丁醇
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W为四种短周期主族元素,它们在周期表中的相对位置如图所示。Z元素原子核外K层与M层电子数相等。下列说法中正确的是
| X | Y | ||
| Z | W |
A.Y元素最高价氧化物对应的水化物化学式为H2YO3
B.原子半径由小到大的顺序为:Y<X<W<Z
C.室温下,Z和W的单质均能溶于浓硝酸
D.X、Z两种元素的氧化物中所含化学键类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
 铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。
铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。
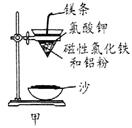
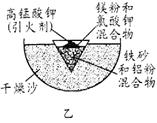

⑴ 某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是 。
⑵ 若证明上述所得“铁块”中含有金属铝,可选择 (填试剂名称),所发生反应的离子方程式为 。
⑶ 为克服图甲的缺陷改用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色。为测定该实验所得 “铁块”的成分,实验流程如图所示。
 |
几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
① 试剂A应选择 ,试剂B应选择 。(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
② 已知常温下Fe(OH)3的Ksp=1.1×10-36,则反应Ⅲ后溶液中c(Fe3+)= mol·L-1。
③ 灼烧完全的标志是 。
④ 若最终红色粉未M的质量为12.0 g,则该“铁块”的纯度是 。如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会 (填“偏大”“偏小”或“无影响”),原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学小组同学向一定量加入少量淀粉的NaHSO3溶液中加入稍过量的KIO3溶液,一段时间后,溶液突然变蓝色。
(1)查阅资料知NaHSO3与过量KIO3反应分为以下两步进行,第一步为IO3-+ 3HSO3-=3SO42-+3H+ + I-,则第二步反应的离子方程式为_____________________________
(2)通过测定溶液变蓝所用时间探究浓度和温度对该反应的反应速率的影响。调节反应物浓度和温度进行对比实验,记录如下:
| 实验编号 | 0.02mol/LNaHSO3溶液/mL | 0.02mol/LKIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
| ① | 15 | 20 | 10 | 15 | t1 |
| ② | a | 30 | 0 | 15 | t2 |
| ③ | 15 | b | c | 30 | t3 |
实验①②是探究______________对反应速率的影响,表中a=________;实验①③是探究温度对反应速率的影响,则表中b=________,c=________
(3)将NaHSO3溶液与KIO3溶液混合(预先加入可溶性淀粉为指示剂),用速率检测仪检测出起始阶段反应速率逐渐增大,一段时间后反应速率又逐渐减小。课题组对起始阶段反应速率逐渐增大的原因提出如下假设,请你完成假设三:
假设一:反应生成的SO42-对反应起催化作用,SO42-浓度越大反应速率越快;
假设二:反应生成的H+对反应起催化作用,H+浓度越大反应速率越快;
假设三:__________________________________________________________;
……
(4)请你设计实验验证上述假设一,完成下表中内容(反应速率可用测速仪测定)
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com