
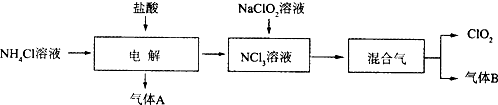
分析 NH4Cl溶液中加入盐酸进行电解得到NCl3,结合元素守恒可知,生成的气体A为H2,NCl3溶液中加入NaClO2溶液,得到ClO2与气体B,气体B能使湿润的红色石蕊试纸变蓝,则B为NH3.
(1)由上述分析可知,电解发生反应:NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑;实验室用氯化铵与氢氧化钙在加热条件下制备氨气,反应生成氯化钙、氨气与水;
由题目信息可知,NCl3极易爆炸,尽量用稀有气体进行稀释,在热水中易分解,电解中应注意:控制好生成NCl3的浓度,控制好反应温度;
(2)NCl3与NaClO2按物质的量之比为1:6混合,在溶液中恰好反应生成ClO2与NH3,由氢元素守恒可知,有水参加反应,1molNCl3得到1molNH3,由ClO2-、ClO2中Cl原子与O原子之比均为1:2,结合电荷守恒可知,反应还生成NaCl与NaOH;
(3)①碘反应完毕,加入最后一滴Na2S2O3溶液,溶液蓝色褪去;
②ClO2与I-反应得到Cl-与I2,由电子转移守恒及已知反应,可得关系式:2ClO2~5I2~10S2O32-,据此计算V1 mL试样中ClO2的物质的量,进而计算100mL溶液中ClO2的物质的量,再结合m=nM计算原10mL溶液中ClO2的浓度;
(4)按一次萃取,设C(H2O)=x,则C(CCl4)=85x,C(H2O)V(H2O)+C(CCl4)V(CCl4)=m(I2)
2x+85x×0.05=0.02
x=0.0032g/L,
残存碘的量m(I2)=2L×0.0032g/L=0.0064g,
按两次萃取设C(H2O)=a(第一次)
2a+85a×0.025=0.02
a=0.0048g/L,
m(I2)=0.0048g/L×2L=0.0096g,
再设C(H2O)=b(第二次),2b+85b×0.025=0.02
b=0.0023g/L,
残存碘量m(I2)=2L×0.0023g/L=0.0046g,
解答 解:NH4Cl溶液中加入盐酸进行电解得到NCl3,结合元素守恒可知,生成的气体A为H2,NCl3溶液中加入NaClO2溶液,得到ClO2与气体B,气体B能使湿润的红色石蕊试纸变蓝,则B为NH3.
(1)由上述分析可知,电解发生反应:NH4Cl+2HCl$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑;实验室用氯化铵与氢氧化钙在加热条件下制备氨气,反应生成氯化钙、氨气与水,反应方程式为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
由题目信息可知,NCl3极易爆炸,尽量用稀有气体进行稀释,在热水中易分解,电解中应注意:控制好生成NCl3的浓度,控制好反应温度;
故答案为:NH4Cl+2HCl$\frac{\underline{\;高温\;}}{\;}$NCl3+3H2↑;2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;控制好反应温度;
(2)NCl3与NaClO2按物质的量之比为1:6混合,在溶液中恰好反应生成ClO2与NH3,由氢元素守恒可知,有水参加反应,1molNCl3得到1molNH3,由ClO2-、ClO2中Cl原子与O原子之比均为1:2,结合电荷守恒可知,反应还生成NaCl与NaOH,反应离子方程式为:NCl3+6ClO2-+3H2O=6ClO2↑+NH3↑+3Cl-+3OH-,
故答案为:NCl3+6ClO2-+3H2O=6ClO2↑+NH3↑+3Cl-+3OH-,
(3)①碘反应完毕,加入最后一滴Na2S2O3溶液,溶液蓝色变为无色,且30s内不变色,说明反应到达终点,
故答案为:溶液蓝色变为无色,且30s内不变色;
②ClO2与I-反应得到Cl-与I2,由电子转移守恒及已知反应,可得关系式:2ClO2~5I2~10S2O32-,则V1 mL试样中ClO2的物质的量为c mol/L×V2×10-3L×$\frac{1}{5}$,故100mL溶液中ClO2的物质的量为为c mol/L×V2×10-3L×$\frac{1}{5}$×$\frac{100ml}{{V}_{1}ml}$,故原10mL溶液中ClO2的质量为c mol/L×V2×10-3L×$\frac{1}{5}$×$\frac{100ml}{{V}_{1}ml}$×68.5g/mol,
浓度.
ClO2与I-反应得到Cl-与I2,由电子转移守恒及已知反应,可得关系式:2ClO2~5I2~10S2O32-,则V1 mL试样中ClO2的物质的量为c mol/L×V2×10-3L×$\frac{1}{5}$,故100mL溶液中ClO2的物质的量为c mol/L×V2×10-3L×$\frac{1}{5}$×$\frac{100ml}{{V}_{1}ml}$,故原10mL溶液中ClO2的质量为c mol/L×V2×10-3L×$\frac{1}{5}$×$\frac{100ml}{{V}_{1}ml}$×67.5g/mol=cV2×10-3×$\frac{1}{5}$×$\frac{100}{{V}_{1}}$×67.5g,即原溶液中ClO2的浓度为(cV2×10-3×$\frac{1}{5}$×$\frac{100}{{V}_{1}}$×67.5g)÷0.01L=$\frac{135c{V}_{2}}{{V}_{1}}$g/L,
故答案为:$\frac{135c{V}_{2}}{{V}_{1}}$;
(4)按一次萃取,设C(H2O)=x,则C(CCl4)=85x,C(H2O)V(H2O)+C(CCl4)V(CCl4)=m(I2)
2x+85x×0.05=0.02
x=0.0032g/L,
残存碘的量m(I2)=2L×0.0032g/L=0.0064g,
按两次萃取设C(H2O)=a(第一次)
2a+85a×0.025=0.02
a=0.0048g/L,
m(I2)=0.0048g/L×2L=0.0096g,
再设C(H2O)=b(第二次),2b+85b×0.025=0.0096
b=0.0023g/L,
残存碘量m(I2)=2L×0.0023g/L=0.0046g,
第二种方法好,
故答案为:0.0064g,0.0046g;
点评 本题考查实验方案的设计,涉及对反应原理的考查、对反应条件的控制、氧化还原反应滴定应用等,注意根据题目信息可知反应条件,较好的考查学生分析问题、解决问题的能力,难度较大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子式为C4H10的烷烃的二氯取代物 | |
| B. | 分子式为C4H10O2的有机物 | |
| C. | 乙苯的一氯取代物 | |
| D. | 和H2加成生成2-甲基戊烷的单烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度范围/℃ | 120-220 | 300-350 | 450-500 | 高于600 |
| 固体/g | 22.05 | 11.25 | 11.85 | 13.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
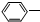 )
)
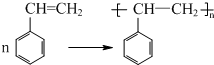 (不要求写出反应条件)
(不要求写出反应条件)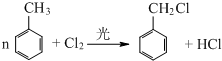 (要求写出反应条件)
(要求写出反应条件)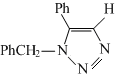 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .亚硫酸钡溶于稀硝酸中:BaSO3+2H+═Ba2++SO2↑+H2O | |
| B. | 向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 向水玻璃中通入少量CO2:SiO32-+2CO2+3H2O═H4SiO4↓+2HCO3- | |
| D. | 用NaOH溶液吸收废气中的氮氧化物:NO+NO2+2OH-═2NO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子键就是使阴、阳离子结合成化合物的静电引力 | |
| B. | 在化合物Na2O2中,阴、阳离子的个数比为1:1 | |
| C. | 在化合物CaCl2中,两个氯离子之间存在共价键 | |
| D. | 含有离子键的化合物一定是离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com