
下列描述中,正确的是( )
A.由 CH3CH2OH(l)+3O2(g) =2CO2 (g)+3H2O(g) ΔH=-1366.8 kJ·mol-1 ,可知乙醇的标准燃烧热为1366.8 kJ·mol-1
B.已知:C(金刚石,s)=C(石墨,s) ΔH<0,则金刚石比石墨稳定
C.已知:N2(g)+O2(g)=2NO(g) ΔH=+180 kJ·mol-1
2CO(g)+O2(g)=2CO2 (g) Δ H=-566 kJ·mol-1则 2CO(g)+2NO(g)===N2 (g)+2CO2(g) ΔH=-746 kJ·mol-1
D.OH-(aq)+H+(aq)===H2O(l) ΔH=-57.3 kJ·mol-1 故1 molHNO3与1mol NH3•H2O 完全反应,放出的热量一定为57.3 kJ·mol-1
科目:高中化学 来源:2016届重庆市高三三诊理综化学试卷(解析版) 题型:选择题
在短周期元素中,X元素与 Y、Z、W三元素相邻,X、Y的原子序数之和等于 Z的原子序数,这四种元素原子的最外层电子数之和为 20。下列判断正确的是
A. 四种元素均可与氢元素形成 18电子分子
B. X、Y、Z、W形成的单质最多有 6种
C. 四种元素中,Z的最高价氧化物对应水化物酸性最强
D. 四种元素的原子半径:rZ>rX>rY>rW
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三考前热身(五模)化学试卷(解析版) 题型:选择题
X、Y、Z、W是原子序数依次增大的短周期元素。X、W同主族,Z、W同周期,X原子核内质子数是Y原子核内质子数的3/4,W原子最外层电子数是Z原子最外层电子数的4倍。下列说法中正确的是
A. 原子半径:r(X)>r(Y)>r(W)>r(Z)
B. 元素W的气态氢化物的热稳定性比元素X的强
C. X、Y、Z三种元素形成的化合物中存在离子键和共价键
D. Y和W形成的化合物的熔点肯定比Y和Z形成的化合物的熔点低
查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三临考模拟化学试卷(解析版) 题型:简答题
设反应①Fe(s)+CO2(g)  FeO(s)+CO(g) 平衡常数为 K1;反应②Fe(s)+H2O(g)
FeO(s)+CO(g) 平衡常数为 K1;反应②Fe(s)+H2O(g) FeO(s)+H 2 (g) 平衡常数为 K2;
FeO(s)+H 2 (g) 平衡常数为 K2;
测得在不同温度下, K1、K2值如下:

(1)在500℃时进行反应①,若CO2起始浓度为1mol·L -1,10分钟后达到平衡,则V(CO)为______。
(2)在 900℃时反应 CO2 (g)+H2(g) CO(g)+H2O(g)的平衡常数 K=___________。
CO(g)+H2O(g)的平衡常数 K=___________。
(3)700℃反应②达到平衡,其它条件不变时,使得该平衡向右移动,可以采取的措施有______(选填编号)。
A.缩小反应器体积 B.加入水蒸气
C.降低温度到500℃ D.加入Fe粉
(4)如果上述反应①在体积不变的密闭容器中发生,能说明反应已达到平衡状态的是________(选填编号)。
A.v正(CO)= v 逆 (CO2) B.C(CO) = C(CO2)
C.容器内气体的密度不变 D.容器内压强不变
(5)若反应①在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后,相应物质的物理量如何变化?(选填“增大”、“减小”或“不变”)
①降低温度,CO2的平衡浓度______________;
②再通入CO2,CO2的转化率_________________。
(6)下列图像符合反应①的是__________(填序号)(图中 v 是速率、φ 为混合其中CO含量,T为温度)

查看答案和解析>>
科目:高中化学 来源:2016届海南师大附中高三临考模拟化学试卷(解析版) 题型:选择题
设 NA为阿伏加德罗常数的数值,下列说法错误的是( )
A.已知 N2 (g)+3H2 (g) 2NH3(g) △H =-92.4 kJ·mol-1,当有 1molNH3时,上述反应的 △H 变为-46.2 kJ·mol-1
2NH3(g) △H =-92.4 kJ·mol-1,当有 1molNH3时,上述反应的 △H 变为-46.2 kJ·mol-1
B.1mol 羟基(—OH)与 17gNH3所含电子数都为NA
C.由 8.0gCH3COONa 和少量 CH3COOH 形成的中性溶液中,CH3COO-数目为0.1NA
D.常温常压下,7.1gCl2与足量的Fe粉反应转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三下冲刺模拟理综化学C卷(解析版) 题型:填空题
黑火药是我国古代四大发明之一,它的爆炸反应为:2KNO3+3C+S═K2S+N2↑+3CO2↑(已配平)
(1)除S外,上列元素的第一电离能从大到小依次为___________________________;
(2)生成物中,A 的电子式为____________;含极性共价键的分子的中心原子轨道杂化类型_____________;
(3)已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为
(4)S的基态原子价层电子排布式为___________,S的一种化合物ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0pm,密度为________g·cm3(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为___________pm。

查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三下冲刺模拟理综化学C卷(解析版) 题型:选择题
短周期X、Y、Z、W四种元素在元素周期表中位置如图所示。有关表述正确的是( )
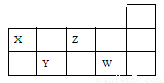
A. X、Y、W的最高价氧化物对应水化物均属强酸
B. Y的氢化物能与Y的最高价氧化物对应水化物反应
C. 原子半径从大到小依次为X>Z>Y>W
D. Z的氢化物的沸点低于W的氢化物
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江牡丹江一中高二6月月考化学试卷(解析版) 题型:选择题
已知高炉炼铁的化学方程式为Fe2O3+3CO 2Fe+3CO2。下列对该反应的叙述不正确的是
2Fe+3CO2。下列对该反应的叙述不正确的是
A.CO是还原剂 B.Fe2O3被还原
C.氧化产物是CO2 D.属于置换反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁沈阳二中高二6月小班成果验收化学卷(解析版) 题型:选择题
已知岩层中的铁橄榄石Fe2SiO4会缓慢转化为磁铁矿:3Fe2SiO4 + 2CO2 ═2Fe3O4 + 3SiO2 + 2CO,下列说法正确的是( )
+ 3SiO2 + 2CO,下列说法正确的是( )
A.氧化产物为Fe3O4和SiO2
B.氧化剂与还原剂物质的量之比为2:3
C.当有1mol CO2参加反 应时,被
应时,被 氧化的Fe2SiO4的物质的量为1mol
氧化的Fe2SiO4的物质的量为1mol
D.当有22.4LCO生成时,转移的电子为 2mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com