
 丙烯腈(CH2═CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产.主要副产物有丙烯醛(CH2═CHCHO)和乙腈(CH3CN)等.回答下列问题:
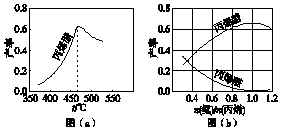
丙烯腈(CH2═CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产.主要副产物有丙烯醛(CH2═CHCHO)和乙腈(CH3CN)等.回答下列问题:分析 (1)依据热化学方程式方向可知,两个反应均放热量大,即反应物和生成物的能量差大,因此热力学趋势大;有利于提高丙烯腈平衡产率需要改变条件使平衡正向进行;
(2)因为该反应为放热反应,平衡产率应随温度升高而降低,即低于460℃时,对应温度下的平衡转化率曲线应该是下降的,但实际曲线是上升的,因此判断低于460℃时,丙烯腈的产率不是对应温度下的平衡转化率;
(3)根据化学反应C3H6(g)+NH3(g)+$\frac{3}{2}$O2(g)=C3H3N(g)+3H2O(g),氨气、氧气、丙烯按1:1.5:1的体积比加入反应达到最佳状态,依据氧气在空气中约占20%计算条件比.
解答 解:(1)两个反应在热力学上趋势均很大,两个反应均放热量大,即反应物和生成物的能量差大,因此热力学趋势大;该反应为气体体积增大的放热反应,所以降低温度、降低压强有利于提高丙烯腈的平衡产率;
故答案为:两个反应均为放热量大的反应;低温、低压;
(2)因为该反应为放热反应,平衡产率应随温度升高而降低,即低于460℃时,对应温度下的平衡转化率曲线应该是下降的,但实际曲线是上升的,因此判断低于460℃时,丙烯腈的产率不是对应温度下的平衡转化率;故答案为:不是;该反应为放热反应,平衡产率应随温度升高而降低;
(3)根据化学反应C3H6(g)+NH3(g)+$\frac{3}{2}$O2(g)=C3H3N(g)+3H2O(g),氨气、氧气、丙烯按1:1.5:1的体积比加入反应达到最佳状态,而空气中氧气约占20%,所以进料氨、丙烯、空气的理论体积约为1:1:7.5,
故答案为:1:1:7.5.
点评 本题考查热化学方程式,影响化学平衡的因素等知识.注意图象分析判断,定量关系的理解应用是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | N2 | B. | O2 | C. | H2O | D. | CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝、氢氧化钠都是常见的胃酸中和剂 | |
| B. | 海轮外壳镶嵌锌块是利用牺牲阳极的阴极保护法 | |
| C. | 水泥、玛瑙、分子筛都是硅酸盐工业产品 | |
| D. | 明矾净水时的作用是杀菌、消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气和二氧化硫都有漂白性,等体积的二者混合会提高漂白效率 | |
| B. | 氢氧化铁胶体在电场的作用下向阳极移动 | |
| C. | 普通玻璃中含有石英、石灰石和纯碱 | |
| D. | 铝制餐具不宜用来长时间存放酸性、碱性或咸的食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2(g)+NO2(g)?SO3(g)+NO(g)△H<0 | B. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | ||
| C. | C(s)+CO2(g)?2CO(g)△H>0 | D. | H2S(g)?H2(g)+S(s)△H>0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com