
碘是人体必需的微量元素之一,有“智力元素”之称。食用加碘食盐可预防碘缺乏病。查阅资料知:①在酸性条件下,I—能被NO3-离子氧化成IO3-离子,被H2O2或O2等氧化成I2;②IO3-离子能被HSO3-离子还原成I2。
请你利用实验室常用仪器和下列限选试剂,依次研究某食盐样品中所加碘的存在形式是I2、I-、IO3-中的哪一种。
限选试剂如下:1.0 mol•L-1HNO3溶液、1.0 mol•L-1 H2SO4溶液、1.0 mol•L-1NaHSO3溶液、3% H2O2溶液、1%淀粉溶液、蒸馏水
Ⅰ.提出假设
假设1:该食盐样品中含I2 ;
假设2:该食盐样品中含I—
假设3: 。
Ⅱ.设计方案与实验探究
将适量食盐样品溶于蒸馏水制成溶液,请按要求填写下表
|
实验步骤 |
预期现象与结论 |
|
步骤1:取少量上述溶液注入试管中,滴入几滴淀粉溶液振荡。 |
若溶液显 ,则假设1成立;否则,假设1不成立,再进行步骤2 |
|
步骤2:
|
若溶液显蓝色,则假设2成立,反应的离子方程式为 ;否则,假设2不成立,再进行步骤3 |
|
步骤3:
|
|
Ⅲ.问题与思考
纯的KIO3或KI都可以作为食用加碘盐中碘的来源。从化学角度来看,试验中添加 (填“KIO3”或“KI”)更好;理由是 。
Ⅰ.该食盐中含有IO3-
Ⅱ.
|
实验步骤 |
预期现象与结论 |
|
步骤1:取少量上述溶液注入试管中,滴入几滴淀粉溶液,振荡。 |
若溶液显蓝色,则假设1成立; 否则,假设1不成立。再进行步骤2. |
|
步骤2:取少量上述溶液注入试管中,加入适量1.0mol/LH2SO4酸化的3%H2O2溶液,再滴入几滴淀粉溶液,振荡。 |
若溶液显蓝色,则假设2成立,反应的离子方程式为2I-+H2O2+2H+=I2+2H2O 否则,假设2不成立。再进行步骤3. |
|
步骤3:取少量上述溶液注入试管中,加入适量1.0mol/L的NaHSO,再滴入几滴淀粉溶液,振荡。 |
若溶液显蓝色,则假设3成立; 否则,假设3不成立。 |
Ⅲ.KI不利于保存,因为KI易被空气中的氧气氧化成I2;
【解析】
试题分析:本题以碘及碘的化学物的性质进行探究。从氧化还原反应的价态律中最低价态只有还原性,高价态具有氧化性。碘单质遇淀粉后变蓝色进行探究。解题的关键在几个氧化还原反应,如碘离子遇强氧化剂氧化为碘单质,碘离子和碘酸根发生归中反应生成碘单质进行分析,得到结论。
考点:本题以探究实验为基础,考查探究实验的基本方法,氧化还原反应基本理论,和实验基本操作方法等。


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:阅读理解
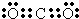
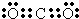
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验步骤 | 预期现象与结论 |
步骤1:取少量上述溶液注入试管中,滴入几滴淀粉溶液振荡. |
若溶液显 蓝色 蓝色 ,则假设1成立;否则,假设1不成立,再进行步骤2 |
步骤2: 取少量上述溶液注入试管中 取少量上述溶液注入试管中 滴入几滴1.0mol?L-1H2SO4溶液和几滴3%H2O2溶液 滴入几滴1.0mol?L-1H2SO4溶液和几滴3%H2O2溶液 再滴入几滴淀粉溶液,振荡 再滴入几滴淀粉溶液,振荡 |
若溶液显蓝色,则假设2成立,反应的离子方程式为 2I-+H2O2+2H+=I2+2H2O 2I-+H2O2+2H+=I2+2H2O ;否则,假设2不成立,再进行步骤3 |
步骤3: 取少量上述溶液注入试管中 取少量上述溶液注入试管中 滴入几滴1.0mol?L-1NaHSO3溶液 滴入几滴1.0mol?L-1NaHSO3溶液 再滴入几滴淀粉溶液,振荡 再滴入几滴淀粉溶液,振荡 |
若溶液呈蓝色,则假设3成立 若溶液呈蓝色,则假设3成立 否则,假设3不成立 否则,假设3不成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。
用化学用语回答下列问题:
(1)L的元素符号为___________;M在元素周期表中的位置为____________________。(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是__________________________。
(3)Y的最高价氧化物的电子式为__________。原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________________________。
(4)Z、W各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为________________________________________________________________。
(5)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一种新型无机非金属材料,其化学式是___________________。
(6)碘是人体必需的微量元素之一,有“智力元素”之称。我国从1989年开始,逐步以KIO3取代KI加工碘盐。已知在酸性溶液中可发生反应: IO3-+ 5I-+ 6H+== 3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在IO3-。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是_________(填序号)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省高三上学期期末检测化学试卷 题型:填空题
(12分)X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。 用化学用语回答下列问题:
(1)L的元素符号为___________;M在元素周期表中的位置为____________________。
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是__________________________(写化学式)。
(3)原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是__________________ __。
(4)Z、W各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为________________________________________________________________。
(5)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一种新型无机非金属材料,其化学式是___________________。
(6)碘是人体必需的微量元素之一,有“智力元素”之称。我国从1989年开始,逐步以KIO3取代KI加工碘盐。已知在酸性溶液中可发生反应: IO3-+ 5I-+ 6H+ == 3 I2 + 3 H 22O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在IO3-。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是_________(填序号)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年北京市高三下学期开学检测化学试卷 题型:填空题
X、Y、Z、W、L、M六种短周期主族元素的原子序数依次增大,其中X、M的单质在常温下呈气态,Y的原子最外层电子数是其电子层数的2倍,Z在同周期的主族元素中原子半径最大,W是地壳中含量最多的金属元素,L的单质晶体熔点高、硬度大,是一种重要的半导体材料。用化学用语回答下列问题:
(1)M在元素周期表中的位置为 。
(2)Y、L、M的最高价含氧酸的酸性由弱到强的顺序是 (写化学式)。
(3)原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
(4)写出Z的最高价氧化物对应的水化物与单质W反应的离子方程式为
。
(5)R与Y同周期,R的单质分子R2中有3个共价键,R与L能形成一种新型无机非金属材料,其化学式是 。
(6)碘是人体必需的微量元素之一,有“智力元素”之称。我国从1989年开始,逐步以KIO3取代KI加工碘盐。已知在酸性溶液中可发生反应: +5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在
+5I-+6H+=3I2+3H2O,据此反应,可用试纸和一些生活中常见的物质设计实验,证明食盐中存在 。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是
(填序号)。
。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食醋;⑥白酒;⑦食糖。你认为进行上述实验时必须使用的物质是
(填序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com