
【题目】(1)甲烷的分子个数为1.204×1023,则甲烷的物质的量为_____mol,所含的原子个数共有______个,与这些甲烷质量相等的O2中氧原子的物质的量为______。
(2)常温常压下,2.8gCO与N2混合气体中含有的原子总数为_____,若氧原子总质量为0.8g,则CO与N2的体积比为_____。
(3)同温同压下,含有相同氧原子数目的CO和CO2两种气体密度之比为_____,质量之比为______。
【答案】0.2 NA 0.2mol 0.2 NA 1:1 7:11 14:11
【解析】
(1)根据n=N/NA计算甲烷物质的量,进而计算甲烷所含原子个数,根据n=m/M计算氧气物质的量,进而计算氧原子物质的量;
(2)CO与N2的摩尔质量均为28g/mol,则混合气体的摩尔质量为28g/mol,先计算混合气体的物质的量,再根据二者均为双原子分子确定原子总数;通过氧原子的质量计算CO的物质的量,进而计算氮气的物质的量,再根据在相同条件下气体的体积比等于物质的量之比,计算二者体积比;
(3)同温同压下,气体物质有以下关系![]() ,据此计算CO和CO2两种气体的密度之比,根据n=N/NA判断含有相同氧原子数目的CO和CO2的物质的量之比,再根据m=nM判断二者质量之比。
,据此计算CO和CO2两种气体的密度之比,根据n=N/NA判断含有相同氧原子数目的CO和CO2的物质的量之比,再根据m=nM判断二者质量之比。
(1)甲烷物质的量为![]() ,甲烷所含原子物质的量为0.2mol×5=1mol,则甲烷所含原子个数为NA;m(O2)=m(CH4)= n(CH4)×M(CH4)=0.2mol×16g/mol=3.2g,氧气物质的量为
,甲烷所含原子物质的量为0.2mol×5=1mol,则甲烷所含原子个数为NA;m(O2)=m(CH4)= n(CH4)×M(CH4)=0.2mol×16g/mol=3.2g,氧气物质的量为![]() ,则氧气所含氧原子物质的量为0.1mol×2=0.2mol;
,则氧气所含氧原子物质的量为0.1mol×2=0.2mol;
故答案为:0.2;NA;0.2mol;
(2)CO与N2的摩尔质量均为28g/mol,则混合气体的摩尔质量为28g/mol,2.8gCO与N2的混合气体的物质的量为![]() ,CO与N2均为双原子分子,则原子总数为0.2NA;CO的物质的量
,CO与N2均为双原子分子,则原子总数为0.2NA;CO的物质的量![]() ,因此N2的物质的量n(N2)=0.1mol-0.05mol=0.05mol,相同条件下气体的体积比等于物质的量之比,则CO与N2的体积比为1:1;
,因此N2的物质的量n(N2)=0.1mol-0.05mol=0.05mol,相同条件下气体的体积比等于物质的量之比,则CO与N2的体积比为1:1;
故答案为:0.2NA;1:1;
(3)同温同压下,气体物质有以下关系![]() ,因此CO和CO2两种气体的密度之比等于二者的摩尔质量之比,即28:44=7:11;根据n=N/NA判断含有相同氧原子数目的CO和CO2的物质的量之比为2:1,又m=nM,则CO和CO2的质量之比为2×28:1×44=14:11。
,因此CO和CO2两种气体的密度之比等于二者的摩尔质量之比,即28:44=7:11;根据n=N/NA判断含有相同氧原子数目的CO和CO2的物质的量之比为2:1,又m=nM,则CO和CO2的质量之比为2×28:1×44=14:11。
故答案为:7:11;14:11。


 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:
【题目】利用下图装置测定中和热的实验步骤如下:

①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。
回答下列问题:
(1)仪器A的名称为_________________________。
(2)倒入NaOH溶液的正确操作是________。
A.沿玻璃缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是________。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
温度 实验 次数 | 起始温度t1/℃ | 终止 温度 t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | _______ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似地认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热ΔH = ______ (取小数点后一位)。
③中和热测定实验中,下列操作一定会降低实验准确性的是________。
A.用滴定管(精量仪器,读数保留到0.01)取所用酸碱溶液的体积
B.NaOH溶液在倒入小烧杯时,有少量溅出
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业涉及固体燃料的气化,需要研究CO2与CO之间的转化。为了弄清其规律,让一定量的CO2与足量碳在体积可变的密闭容器中反应:C(s)+CO2(g)![]() 2CO(g) H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:
2CO(g) H,测得压强、温度对CO、CO2的平衡组成的影响如图所示:
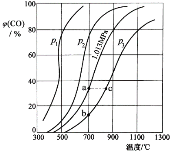
回答下列问题:
(1)p1、p2、p3的大小关系是______________,欲提高C与CO2反应中CO2的平衡转化率,应采取的措施为 。图中a、b、c三点对应的平衡常数大小关系是____________。
(2)900 ℃、1.013 MPa时,1 mol CO2与足量碳反应达平衡后容器的体积为V,CO2的转化率为_________,该反应的平衡常数K= 。
(3)将(2)中平衡体系温度降至640 ℃,压强降至0.1013 MPa,重新达到平衡后CO2的体积分数为50%。条件改变时,正反应和逆反应速率如何变化?_______,二者之间有何关系?____________________。
(4)一定条件下,在CO2与足量碳反应所得平衡体系中加入H2和适当催化剂,有下列反应发生:CO(g)+3H2(g)![]() CH4(g)+H2O(g) H1=-206.2 kJ/mol
CH4(g)+H2O(g) H1=-206.2 kJ/mol
CO(g)+H2O(g)![]() CO2(g)+H2(g) H2=-41.2 kJ/mol
CO2(g)+H2(g) H2=-41.2 kJ/mol
① 则二氧化碳与氢气反应转化为甲烷和水蒸气的热化学方程式是_________________。
② 已知298 K时相关化学键键能数据为:
化学键 | H—H | O—H | C—H |
|
E/(kJ·mol-1) | 436 | 465 | 413 | 1076 |
则根据键能计算,H1= ,它与上述实测值差异较大的原因可能是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%,二氧化碳(CO2)的排放量也要大幅减少。
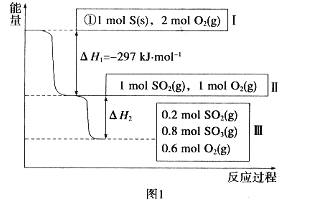
(1)在恒温,容积为1 L容器中,硫可以发生如下转化,其反应过程和能量关系如图1所示。已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1,回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1,回答下列问题:
①写出能表示硫的燃烧热的热化学方程式: _____________________________
②ΔH2=__________kJ·mol-1。
③在相同条件下,充入1 mol SO3和0.5 mol的O2,则达到平衡时SO3的转化率为___________;此时该反应________(填“放出”或“吸收”)________kJ的能量。
(2)中国政府承诺,到2020年单位GDP二氧化碳排放比2005年下降40%~50% 。
①CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。此条件下该反应的平衡常数为__________
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。此条件下该反应的平衡常数为__________

②能说明上述反应达到平衡状态的是______(填编号)
A、反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B、混合气体的密度不随时间的变化而变化
C、CO2的体积分数在混合气体中保持不变
D、单位时间内消耗3 mol H2,同时消耗1 mol H2O
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有________(填编号)。
A.升高温度B.缩小容器体积C.再充入CO2气体D.使用合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量浓度相同的NaCl、MgCl2、AlCl3三种溶液,当溶液体积比为3:2:1时,三种溶液中Cl﹣的物质的量之比为
A. 3:4:3B. 1:2:3C. 3:2:1D. 1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在元素周期表中的位置如右下图所示,下列说法正确的是 ( )
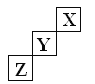
A. X、Y、Z三种元素中,X的非金属性最强
B. 常压下X的单质的熔点比Z的低
C. Y的最高正化合价为+7
D. Y的氢化物的稳定性比Z的弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将Cl2缓慢通入100mL水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol/L NaOH溶液,整个过程中pH的变化如图所示。下列有关叙述中正确的是

A. 曲线③④段有离子反应:HClO+OH-=ClO-+H2O
B. 可依据②处数据计算所溶解的n(Cl2)
C. ③处表示氯水与氢氧化钠溶液恰好反应完全
D. ①处c(H+)约为②处c(H+)的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种无机矿物质X(仅含四种元素)的组成和性质,设计并完成如下实验:

另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1.请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图_______,写出气体甲的电子式_______。
(2)X的化学式是______,在惰性气流中加热X至完全分解的化学反应方程式为_______。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是_______(用化学反应方程式表示)。
(4)一定条件下,气体甲鱼固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式_______,并设计实验方案验证该反应的产物_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com