
 某有机物结构简式如图.一定条件下,该物质与甘氨酸(NH2-CH2-COOH)混合发生反应生成的链状二肽有( )
某有机物结构简式如图.一定条件下,该物质与甘氨酸(NH2-CH2-COOH)混合发生反应生成的链状二肽有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
科目:高中化学 来源: 题型:选择题
| A. | 滤液中一定有Cu2+ | B. | 滤液中一定无Cu2+ | ||
| C. | 滤液中一定有Fe3+ | D. | 滤液中一定无Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
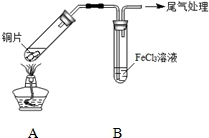 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示.| 步骤① | 配制1mol•L-1 FeCl3溶液(未用盐酸酸化),测其pH约为1,取少量装入试管B中,加热A. |
| 步骤② | 往5mL 1mol•L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO和Al2O3均只能与酸反应,不能与碱反应 | |
| B. | Na和Fe在一定条件下与水反应都生成H2和对应的碱 | |
| C. | Mg和Al都可以用电解法冶炼得到 | |
| D. | Na2O和Na2O2与CO2反应产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
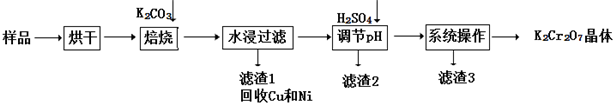
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0 | B. | 0.25a | C. | 0.45a | D. | 0.50a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体的密度不变 | B. | 混合气体的平均相对分子质量不变 | ||
| C. | v正(CO)=2v逆(H2) | D. | CO(g)、CH3CH2OH(g)的分子数之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个二氧化碳分子和0.5mol甲烷的质量比为11:4 | |
| B. | 1molCl2作为氧化剂得到的电子数为NA | |
| C. | 在0℃,101kPa时,11.2L氢气中含有0.5NA个氢原子 | |
| D. | 14g氮气中含有7NA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com