
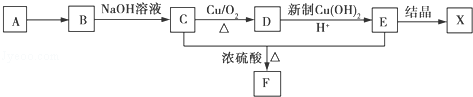
 ��
������ ����A���ܶȺ�̼Ԫ�ص�����������֪AΪ��ϩCH2=CH2�����ת����ϵͼ��BΪ1��2-��±����CH2XCH2X������NaOH��Һ��ˮ���HOH2C-CH2OH��CΪ�Ҷ������Ҷ���������DΪ�Ҷ�ȩHOC-CHO���Ҷ�ȩ������������ͭ����ΪE��EΪ�Ҷ���HOOC-COOH��C�Ҷ�����E�Ҷ��ᷢ��������Ӧ����Ԫ����FΪ �����οɽ��1������3���⣻��4���л���W�Ƿǵ���ʣ����ܷ������룬����±����������ȡ����±�����ӣ���5����F�ṹ���ƣ���4��Cԭ�ӣ���1H-NMR��ͼ��ֻ��һ���壬��Cԭ��ֻ��4�����ݴ��ƶϣ���6������������ԭ��Ӧ��
�����οɽ��1������3���⣻��4���л���W�Ƿǵ���ʣ����ܷ������룬����±����������ȡ����±�����ӣ���5����F�ṹ���ƣ���4��Cԭ�ӣ���1H-NMR��ͼ��ֻ��һ���壬��Cԭ��ֻ��4�����ݴ��ƶϣ���6������������ԭ��Ӧ��
��� �⣺����A���ܶȺ�̼Ԫ�ص�����������֪AΪ��ϩ�����ת����ϵͼ��BΪ1��2-��±���飬����NaOH��Һ��ˮ���C��CΪ�Ҷ������Ҷ���������DΪ�Ҷ�ȩ���Ҷ�ȩ������������ͭ����ΪE��EΪ�Ҷ��ᣬC�Ҷ�����E�Ҷ��ᷢ��������Ӧ����Ԫ����F��
��1��CΪ�Ҷ������ṹ��ʽΪ��HOCH2CH2OH����X���Ҷ�����Һ�ᾧ����Ҷ�����C��H��Oԭ�Ӹ�����Ϊ1��2��2��X��C��H��Oԭ�Ӹ�����Ϊ1��3��3��˵���Ҷ���ᾧʱ�нᾧˮ��Ӧ��H2C2O4•2H2O��
�ʴ�Ϊ��HOCH2CH2OH��H2C2O4•2H2O��
��2��AΪ��ϩ�����ת����ϵͼ��BΪ1��2-��±���飬����NaOH��Һ��ˮ���C��CΪ�Ҷ������Ҷ���������DΪ�Ҷ�ȩ���Ҷ�ȩ������������ͭ����ΪE��EΪ�Ҷ��ᣬC�Ҷ�����E�Ҷ��ᷢ��������Ӧ����Ԫ����F�����Ԣ�A��BΪ�ӳɷ�Ӧ����B��Cȡ����Ӧ����C��DΪ������Ӧ����D��EΪ������Ӧ����C��E��FΪ���۷�ӦҲ�ɿ���ȡ����Ӧ��
�ʴ�Ϊ���ڢݣ�
��3��D���Ҷ�ȩ������Cu��OH��2����Һ��Ӧ�ķ���ʽΪOHC-CHO+4Cu��OH��2+2NaOH$\stackrel{��}{��}$NaOOC-COONa+2Cu2O��+6H2O��C���Ҷ���E���Ҷ��ᣬC��Eͨ�����۷�Ӧ���ɸ߷��ӻ�����Ļ�ѧ����ʽΪ��nHOOC-COOH+nHOCH2-CH2OH$��_{��}^{����}$H-[OCH2CH2OOC-COOCH2CH2O]n-OH+��2n-1��H2O��
�ʴ�Ϊ��OHC-CHO+4Cu��OH��2+2NaOH$\stackrel{��}{��}$NaOOC-COONa+2Cu2O��+6H2O��nHOOC-COOH+nHOCH2-CH2OH$��_{��}^{����}$H-[OCH2CH2OOC-COOCH2CH2O]n-OH+��2n-1��H2O��
��4��BΪ1��2-��±���飬�Ƿǵ���ʣ����ܵ����±�����ӣ�������NaOH��Һ��ˮ���±�����ӣ����������кͳ����ԣ�Ȼ�����AgNO3��Һ��ͨ���۲�±������������ɫȷ��±�����࣬
�ʴ�Ϊ��ȡ����B��NaOH��Һ���ȣ��ټ��������ữ��Ȼ�������������Һ���۲����ɳ�������ɫ��
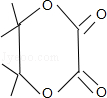
��5����֪F�����к���һ����Ԫ����C���Ҷ���E���Ҷ��ᣬC��E���ɵ�FӦ��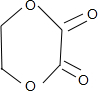 ����ͬϵ��W��F��4��C����Hԭ�ӵ�Ч������Ϊ
����ͬϵ��W��F��4��C����Hԭ�ӵ�Ч������Ϊ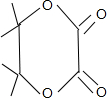 ��
��
�ʴ�Ϊ�� ��
��
��6��Y������ɱ�E��һ����ԭ�ӣ���Y�Ľṹ��ʽΪ��OHC-COOH��ͨ����ⷽ������E��ȡY������������ͨ����ʯī�������ø���Ĥ�缫�����������ӽ���Ĥ���������ҺΪ����E������Ļ����Һ���������Ҷ���õ��Ӻ������ӷ�Ӧ����OHC-COOH��ˮ�����������ĵ缫��Ӧʽ��HOOC-COOH+2H++2e��=OHC-COOH+H2O��
�ʴ�Ϊ��HOOC-COOH+2H++2e-�THOOC-CHO+H2O
���� ���⿼�����л�����ƶϼ����ԭ������ȷ�л���Ĺ����ż��������ǽⱾ��ؼ���ע��±������±ԭ�ӵļ��鷽����ע��±ԭ�Ӽ���ʱҪ�������кͼȻ���ٺ���������Ӧ��Ϊ�״��㣬��Ŀ�ѶȽϴ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2.0mol/L | B�� | 1.5 mol/L | C�� | 0.18 mol/L | D�� | 0.24mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����Ӧ��ԭ���ԭ�������˶��ֵ�أ������㲻ͬ����Ҫ������ÿС���еĵ�ع㷺ʹ�����ճ���������Ϳ�ѧ�����ȷ��棬����������ṩ����Ϣ����д�ո�
����Ӧ��ԭ���ԭ�������˶��ֵ�أ������㲻ͬ����Ҫ������ÿС���еĵ�ع㷺ʹ�����ճ���������Ϳ�ѧ�����ȷ��棬����������ṩ����Ϣ����д�ո��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڼ��Ƚ��������¼���MgO���ɳ�ȥMgCl2��Һ�е�Fe3+ | |
| B�� | 40mLlmol/LCH3COONa��Һ��20mLlmol/LHCl��Һ��Ϻ���Һ�����ԣ�������Һ�У�c ��CH3COO-����c��Cl-����c��H+����c��OH-�� | |
| C�� | �����£�Cd��OH��2��Co��OH��2�Ļ������Һ�У�c��Cd2+����c��Co2+����3.5�� ��֪��Ksp[Cd��0H��2]=7.2��10-15��Ksp[Co��0H��2]=1.8��10-15 | |
| D�� | �����£�CH3COONa��CH3COOH�Ļ����Һ�У�pH=7����c��Na+��=c��CH3COO-����c��H+��=c��OH-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 4��3 | B�� | 3��4 | C�� | 3��2 | D�� | 2��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  2-���ȱ��� 2-���ȱ��� | B�� | 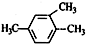 1��2��4-���ױ� 1��2��4-���ױ� | C�� |  2-��-1-���� 2-��-1-���� | D�� |  2-��-3-��Ȳ 2-��-3-��Ȳ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ۢ� | B�� | �ڢۢܢ� | C�� | �ڢܢݢޢ� | D�� | �٢ڢۢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NaCl | B�� | CaCl2 | C�� | AlCl3 | D�� | MgSO4 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com